Zum Wohle der Patienten schauen internationale und nationale Behörden wie die amerikanische Food and Drug Administration (FDA), die European Medicine Evaluation Agency (EMEA) und die Inspektionsbehörden in den deutschen Bundesländern den Herstellern von Arzneimitteln kritisch über die Schulter. Produzenten müssen prüfen und nachweisen, dass Computersysteme im Rahmen der eigenen Arbeitsprozesse einwandfrei funktionieren und die Validierungsrichtlinien erfüllen.
Dominic Konrad
Doch keine Validierung ist wie die andere, und die Vorschriften in diesem Bereich sind sehr vielfältig und unübersichtlich. Hilfestellung für die Umsetzung bieten zahlreiche Dokumente, die seit den 80er Jahren von verschiedenen internationalen Organisationen erarbeitet wurden. Obwohl die Inspektionen zur Validierung von computergestützten Systemen in den deutschen Bundesländern noch unterschiedlich gehandhabt werden, sind heute in Deutschland die im EU-GMP-Leitfaden (Annex 11) festgelegten Validierungsanforderungen verbindlich. Zwischen der EU-Kommission und der FDA wurde außerdem im MUR-Abkommen die Angleichung der Inspektionsstandards vereinbart, sodass sich für viele deutsche Arzneimittelhersteller die Messlatte für die Validierung erhöht. Das trifft besonders mittelständische Unternehmen, bei denen individuell entwickelte und zum Teil hochbetagte Softwarelösungen im Einsatz sind, die sich nur mit hohem Aufwand retrospektiv validieren lassen. Viele entscheiden sich in dieser Situation für einen IT-Generationswechsel, weil dieser ihnen neben einer durchgängigen Systemunterstützung für alle Geschäftsprozesse auch eine effiziente prospektive Validierung ermöglicht.
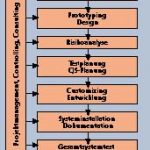
Die prospektive Validierung eines computergestützten Systems ist eng an seinen Lebenszyklus gebunden und begleitet alle Phasen der Einführung und des Einsatzes. So umfasst eine Software-Einführung mit prospektiver Validierung – wie jede andere Software-Einführung auch – die Phasen: Projektplanung, Geschäftsprozess-Analyse, Prototyping und Design, Customizing und Entwicklung, Systeminstallation und Dokumentation, Tests sowie den Produktivstart. Die Systemeinführung inklusive Validierung legt aber einen deutlich strengeren Qualitätsmaßstab an und ist vor allem durch vier zusätzliche Aufgabenbereiche gekennzeichnet:
• Qualitätssicherung durch den Software-Anbieter,
• ausführliche Validierungsplanung,
• Risikoanalyse und
• umfassende Tests.
Qualitätssicherung durch den Software-Anbieter
Die Validierung eines computergestützten Systems greift schon, bevor es überhaupt beim Arzneimittelhersteller zum Einsatz kommt, denn auch der Lieferant muss den Qualitätsanforderungen der Validierungsrichtlinien genügen. Dazu gehört nicht nur, dass er bei der Software-Entwicklung ein Qualitätssicherungssystem anwendet und alle Phasen validierungsgerecht plant, durchführt und dokumentiert. Er muss ebenso dafür sorgen, dass seinen Mitarbeitern die gesetzlichen Validierungsanforderungen und die Standards der GMP (Good Manufacturing Practice) bekannt sind. Und sogar sein Vertragsmanagement muss der Software-Anbieter – zum Beispiel hinsichtlich klarer Abgrenzung von Verantwortlichkeiten und geforderter Projektdokumentation – am EU-GMP-Leitfaden ausrichten. Pharma-Unternehmen, die sich für den Einsatz eines neuen Softwaresystems und eine prospektive Validierung entscheiden, sind also gut beraten, den IT-Lieferanten rechtzeitig auf diese Dinge hin zu durchleuchten. So wird sichergestellt, dass das eigentliche Projekt qualitativ, zeitlich und finanziell im geplanten Rahmen bleibt.
AusführlicheValidierungsplanung
Die Einführung und Validierung eines Softwaresystems muss sehr detailliert geplant werden. Der Validierungsplan ist der Kompass für das gesamte Projekt. Hier werden Phasen, Einführungsmethodik und Teilprojekte festgelegt, Verantwortliche definiert, Dokumentationen aufgelistet und geltende Standards beschrieben.
Risikoanalyse
Welche Fehler sind durch den Einsatz computergestützter Systeme möglich? Welche Fehler sind kritisch für die Arzneimittel- und Patientensicherheit? In der Risikoanalyse werden alle kritischen Daten und Geschäftsprozesse, die mit dem computergestützten System in Berührung kommen, auf potenzielle Risiken analysiert. Dabei wird geprüft, wie sich mögliche Systemfehler, Anwendungsfehler oder Missbrauch im Umgang mit Stammdaten, Geschäftsprozessen, Softwareprogrammen, Schnittstellen und Netzwerken auswirken können. Notwendige technische und organisatorische Qualitätssicherungsmaßnahmen werden festgelegt. Dazu gehören Berechtigungskonzepte, die Sicherheitsstufen verschiedener Anwender definieren und beispielsweise festhalten, wer Rezepturen oder den Qualitätsstatus einer Charge verändern darf. Dazu gehören auch Audit Trails, die zum Beispiel wie ein Logbuch alle kritischen Systemeingaben mit kompletter Historie speichern und im Fehlerfall eine durchgängige Rückverfolgung nachweispflichtiger Daten ermöglichen. Außerdem werden Testumfang und Testtiefe für das computergestützte System festgelegt.
Umfassende Tests
Während bei einer Systemeinführung im allgemeinen vor allem überprüft wird, ob es die erforderlichen Funktionen erfüllt, muss in einem Validierunsprojekt auch getestet werden, wie sich das System in realistischen Fehler- und Ausnahmefällen verhält:
• Kann eine Rohstoffcharge in Quarantäne versehentlich für die Produktion freigegeben werden?
• Wann wird der Fehler bemerkt?
• Wie wird er eindeutig identifiziert?
Notwendige Test- und QS-Maßnahmen werden erarbeitet und in Testplänen und SOPs (Standard Operating Procedures) festgehalten.
E cav 303
sqlblending ERP-Standardsoftware
Die komponentenbasierte ERP-Standardsoftware SQLblending ist für mittelständische Unternehmen aus der Prozessindustrie konzipiert. Mit SQLblending lassen sich alle betriebs- und materialwirtschaftlichen Prozesse rezepturorientierter Fertiger durchgängig abwickeln. Die Windows-basierte Branchenlösung besteht aus variabel kombinierbaren Komponenten für die chargengerechte Materialwirtschaft, die rezepturorientierte Produktionsplanung und -steuerung, für sicheres Gefahrstoffmanagement und das Rechnungswesen. Die Produktpalette wird von Softmatic durch Beratung, Implementierung, Training und kontinuierliche Betreuung ergänzt.
Nachgefragt Softmatic und die Validierung von Computersystemen
cav Herr Konrad, Softmatic ist ein Softwarehaus, das ERP-Standardsoftware vermarktet. Warum ist dann Validierung ein Thema für Sie?
Konrad Wir haben uns als Anbieter der ERP-Standardsoftware SQLblending auf Mittelständler in der Prozessindustrie spezialisiert, weil wir die rezepturorientierte Fertigung in der pharmazeutischen Industrie seit vielen Jahren kennen – und schon sind wir beim Thema. Je wichtiger die Validierung für unsere Kunden wird, desto wichtiger ist sie für uns. Gemeinsam mit ihnen haben wir deshalb bereits 1997 Standards und Methoden für eine prospektive Validierung bei der Einführung unserer Branchenlösung erarbeitet und Fachleute an Bord geholt. Neue Kunden profitieren davon: Sie setzen von Anfang an auf ein leicht validierbares System und auf ein auditerfahrenes Unternehmen.
cav Softmatic hat das Ready for Validation-Programm ins Leben gerufen. Was verbirgt sich dahinter?
Konrad Ready for Validation ist unser Consulting-Programm. Wir führen nicht nur unsere Standardsoftware ein, sondern beraten Unternehmen gleichzeitig im Management von Validierungsprojekten über alle Projektphasen hinweg. Gerade Mittelständler verfügen ja häufig nicht – wie die Großen der Branche – über üppige finanzielle Ressourcen oder über Stabsabteilungen, die sich ganz der Validierung widmen können. „Ready for Validation“ beginnt allerdings schon bei der Entwicklung unserer Standardsoftware. Wir entwickeln SQLblending im Rahmen eines Qualitätssicherungssystems, das sich am Lebenszyklus des Systems orientiert. Dabei werden für jedes neue Release Aktivitäten und Dokumente so geplant und realisiert, wie es auch für eine prospektive Computersystem-Validierung notwendig ist. Vorlagen für alle notwendigen Pläne, SOPs (Standard Operating Procedures) und Qualifizierungsberichte stellen wir bereit und erleichtern unseren Kunden damit die Validierung enorm.
cav Bei Softmatic greifen Software-Einführung und Validierung also eng ineinander. Hat das – neben den organisatorischen – auch finanzielle Vorteile?
Konrad Sicher. Nach unseren Erfahrungen kann die Validierung eines computergestützten Systems ohne planmäßige Vorbereitung durch den Software-Anbieter leicht 50% der Kosten ausmachen. Durch „Ready for Validation“ lässt sich eine effiziente Validierung gewährleisten und der Aufwand um bis zu 40% reduzieren, weil viele Vorlagen bereitgestellt und laufend den aktuellen gesetzlichen Anforderungen angepasst werden.
Unsere Webinar-Empfehlung
Der Webcast MTP und modulare Produktion bietet eine einzigartige Gelegenheit, mehr über die aktuellen Entwicklungen bei MTP und in der modularen Produktion zu erfahren.
Chemie- und Pharmaproduktion braucht mehr Flexibilität
In der heutigen sich schnell wandelnden Welt stehen…
Teilen: