Die Zeiten, in denen die Lupine und daraus hergestellte Lupinenprodukte ein Schattendasein führten, sind endgültig vorbei. Lupinenprotein avanciert als wertvolle Lebensmittelzutat zu mehr als nur einem Geheimtipp bei Anwendungen in Fleisch- und Milchprodukten sowie in Backwaren.
Dipl. Ing. Stefan Lander
Botanisch gesehen gehört die Lupine (Abb. 1) zur Familie der Leguminosen (Schmetterlingsblütler). Sie ist eine meist einjährige, aber auch in ausdauernder Kultur vorkommende, mehr als 200 Arten umfassende Pflanzenart mit einer lederartigen Frucht in Form einer Hülse. Industriell von Bedeutung sind insbesondere Lupinus albus, Lupinus luteus sowie Lupinus angustifolius als alkaloidarme Typen.
Die weiße Lupine war bereits im alten Ägypten, Griechenland und bei den Römern Kulturpflanze. Schon der berühmteste Arzt des Altertums Hippokrates (460 v. Chr.) lobte diese Pflanze wegen ihrer hohen Verdaulichkeit. In Pharaonengräbern dienten Lupinensamen als Grabbeigabe. Wegen ihres bitteren Geschmacks wurde die Lupine in ihren Ursprungsländern früher als Zusatz bei der Bierherstellung genutzt. In anderen Ländern des Mittelmeerraums wurden die gekochten, ausgelaugten Samen gesalzen oder in Soßen verzehrt. In Italien, Ägypten und Algerien verkauften Straßenhändler Lupinensamen ungesalzen als eine Art Leckerbissen. Auch als Kaffee-Ersatz kamen die gerösteten Lupinensamen zum Einsatz.
Ab 1850 entdeckte man dann auch den hohen Wert der Lupine als Zwischenfrucht, denn mit ihren bis zu 100 cm langen Pfahlwurzeln bewirkt sie eine locker-krümelige Struktur des Bodens und führt so auch zu einer guten Belüftung. Weiterhin führt die Symbiose mit Knöllchenbakterien der Gattung Rhizobium zu einer beachtlichen Stickstoffanreicherung (40-80 kg/ha) im Boden, der nachgelagerten Anbaufolgen zur Verfügung steht und somit gleichzeitig auch die zusätzlich nötigen Düngergaben reduziert. Die ursprünglichen Lupinenarten enthielten eine Gruppe von verschiedenen Chinolizidin-Alkaloiden, wobei hauptsächlich Lupinin, Spartein und ß-Isospartein vorkommen, die auch für den unangenehmen bitteren Geschmack verantwortlich sind. 1927 gelang es den deutschen Botanikern Bauer und Sengbusch, alkaloidarme süße Sorten zu züchten, womit Lupinenprodukten endgültig der Weg als Lebensmittel geebnet wurde. Der Gehalt dieser Bitterstoffe ist in den heutigen alkaloidfreien Süßlupinensorten auf 0,0-0,004% reduziert worden und somit für den Menschen nicht mehr wahrzunehmen und damit in keinster Weise bedenklich. Vorteilhaft beim Anbau von Lupinen ist zudem, dass dies auch in Europa möglich ist, d.h. ein langer Transport wie bei Sojabohnen entfällt.
Gewinnung des Lupinenproteins Vitaprot
Bei der Herstellung des Proteinkonzentrats wird die ausgeprägte Kaltwasserlöslichkeit der Lupinenproteine ausgenutzt. Nach dem Entfernen der Schalen werden durch wässrige Extraktionen Fraktionen gewonnen, die vorwiegend aus Globulinen bestehen. Analytisch lassen sich diese in fünf weitere Untereinheiten auftrennen. Tabelle 1 zeigt die Zusammensetzung des Lupinenproteinkonzentrats. Im Gegensatz zur Gewinnung von Sojaprodukten, wird mit niedrigen Extraktionstemperaturen ohne Verwendung von chemischen Lösemitteln gearbeitet. Durch den ausbleibenden Erhitzungsschritt wird das Protein nicht denaturiert und behält dadurch seine natürlichen Eigenschaften bei. Dies ist wichtig im Hinblick auf die technologischen Eigenschaften wie Löslichkeit und Emulgierfähigkeit. Die Emulsionsstabilität beträgt bei einer Emulsion Lupinenprotein (1 Teil), Wasser (5 Teile) und Öl (5 Teile) 100 %; wenn die Teile Öl und Wasser jeweils auf 7 angehoben werden, ergibt sich immer noch eine Emulsionsstabilität von 74%, wobei diese sowohl bei 20 °C als auch bei 80 °C erreicht wird. Es kann daher von einer relativen Temperaturunabhängigkeit ausgegangen werden.
Ernährungsphysiologische Eigenschaften
Nahrungsmittelallergien sind weit verbreitet und nehmen leider weiterhin zu. In den meisten Fällen liegen Abwehrreaktionen des Immunsystems gegen Proteine vor, die durch einen unvollständigen Abbau von Nahrungsproteinen zu Aminosäuren hervorgerufen werden. Die häufigsten allergieauslösenden Nahrungsmittel sind dabei Kuhmilch und Hühnereiweiß. Allergische Reaktionen, die auf den Verzehr von Lupinenprotein zurückzuführen sind, sind in Deutschland lediglich bei Erdnussallergie in sehr leichter Form bekannt. Ein eventuell erhöhtes Allergierisiko durch den Verzehr von Lupinensamen und deren Abkömmlinge versuchten die Wissenschaftler Feldmann und Gross vom Institut für Humanernährung und Lebensmittelkunde der Universität Kiel in Zusammenarbeit mit der Deutschen Gesellschaft für Technische Zusammenarbeit (FTZ) in Eschborn durch eine Studie in Peru herauszufinden. Die über mehrere Jahre laufende Untersuchung konnte kein erhöhtes Allergierisiko feststellen.
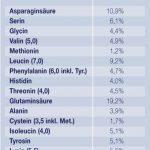
Lupinensamen enthalten von Natur aus 35 bis 45% hochwertiges Protein, das über alle essentiellen Aminosäuren verfügt. Tabelle 2 zeigt hierzu die Zusammensetzung. Das Lupinenprotein Vitaprot enthält keine Stärke, dafür einen erheblichen Anteil an löslichen Ballaststoffen, insbesondere Oligosaccharide, wobei diese keine blähende Wirkung haben. Auffallend ist außerdem der hohe Gehalt an Vitamin B12 sowie an Carotinoiden, die als Antioxidantien wirken.
Lebensmittelrechtliche Einstufung
Die heutigen Lupinenprodukte, die aus den Süßlupinenarten gewonnen werden, haben nur noch einen äußerst geringen Anteil von Alkaloiden. In England hat sich die Advisory Committee on Novel Foods and Processes (ACNFP) ausführlich mit dem lebensmittelrechtlichen Status auseinandergesetzt und festgelegt, dass Lupinenprodukte dann als sicher gelten können, wenn ihr Alkaloidgehalt 200 mg/kg nicht überschreitet. Diese Forderung ergibt sich schon allein aus sensorischen Gründen, so dass keine spezielle Überwachung nötig ist.
Da, wie bereits eingangs erwähnt, Lupinenprodukte schon vor ca. 3000 Jahren im Mittelmeerraum verwendet wurden, sind auch heutzutage verwendete vergleichbare Konzentrate bzw. Extrakte keine neuartigen Erzeugnisse im Sinne der EG-Verordnung Nr. 258/97 (Novel Food Verordnung).
Lupinen sind gentechnisch nicht verändert und schaffen damit eine wichtige Vertrauensbasis für den Verbraucher, der zunehmend für dieses Thema, insbesondere aufgrund der Diskussion bei Sojaprodukten, sensibilisiert wird.
Im Hinblick auf die Verwendung von Lupinenprotein in Fleischprodukten (Abb. 2), erlaubt es die deutsche Fleischverordnung bei der Herstellung von Fleischerzeugnissen, Stärke und pflanzliches Eiweiß zuzusetzen, wobei die Verwendung dieser Zutaten in Verbindung mit der Verkehrsbezeichnung deklariert werden muss.
Lupinenprotein in Brühwürsten
Um die positiven Eigenschaften des Lupinenproteins Vitaprot zu untersuchen, führte die Firma J. Rettenmaier & Söhne Versuche in Zusammenarbeit mit der Bundesforschungsanstalt für Fleischforschung in Kulmbach durch, um vergleichende Werte zu Produkten zu erhalten, die auf ähnliche Art eingesetzt werden. Es wurde dabei auf die Standardrezeptur nach Tabelle 3 zurückgegriffen. Als Referenzchargen waren jeweils eine Kontrollcharge ohne und mit Phosphat vorgesehen. Für die Versuche wurden insgesamt fünf Chargen mit den folgenden Produkten hergestellt:
• Charge 1: Kontrollcharge ohne Phosphat
• Charge 2: Kontrollcharge mit Phosphat
• Charge 3: mit 2% Lupinenprotein
• Charge 4: mit 2% Natriumkaseinat
• Charge 5: mit 2% einer 50 : 50 Mischung aus Lupinenprotein und Pulvercellulose (Faserlänge: 200 µm)
Entsprechend dem jeweiligen Proteingehalt wurde Fleisch aus der Basisrezeptur herausgenommen und durch Protein und Wasser ersetzt. Der Versuchsablauf gliederte sich in folgende Schritte:
• Das Fleisch- und Fettgewebe wurden getrennt vorgewolft und jeweils gut gemischt. Die Lagerung beider Gewebe erfolgte über Nacht im Kühlraum bei +2 °C.
• Das gekühlte Fleisch wurde vorgekuttert, dann das Salz und gegebenenfalls Phosphat zugegeben. Im Anschluss wurde das Eis stufenweise zugesetzt. Nach weiterem Kuttern gab man das Fettgewebe sowie die trockenen Zutaten zu. Die Endtemperatur des Kuttervorgangs war 12 °C
• Das Brät wurde in innenbeschichtete Faserdärme, Kaliber 90 mm, sowie in Dosen, 73 x 58 mm gegeben.
• Die Würste wurden in einem Dampfkochschrank 30 min bei 50 °C umgerötet und bei 75 °C für 90 min erhitzt und anschließend bis 20 °C Kerntemperatur im Wasserbad gekühlt. Die Dosen sterilisierte man im Standautoklaven 70 min bei 110 °C auf einen Fc-Wert von ca. 0,6 (Dreiviertelkonserve). Bis zur Untersuchung wurden die Produkte beider Erhitzungsstufen bei +2 °C gelagert.
• Die Beurteilung der Fertigprodukte erfolgte visuell und sensorisch. Weiterhin wurden Farbmessungen mit dem Hunter Lab Farbmessgerät Colour Quest, Festigkeitsmessungen mit der Instron 1140 durchgeführt sowie der Geleeabsatz untersucht.
Versuchsergebnisse
Die Verarbeitung des Lupinenproteins Vitaprot sowie des Gemisches aus Lupinenprotein und Pulvercellulose war problemlos und zeigte keine Besonderheiten im Vergleich zu anderen Pulverzugaben. Die Beurteilung der Produkte fand nach 12 Tagen Kühllagerung statt. Als Referenz dienten die beiden Kontrollchargen jeweils mit bzw. ohne Phosphat. Die sensorische Beurteilung ergab keine unmittelbare Beeinflussung durch das Lupinenprotein. Im direkten Vergleich der Chargen 4 und 5 konnte kein Unterschied festgestellt werden. Eine deutliche Festigkeitszunahme der Produkte mit Lupinenprotein gegenüber den Kontrollprodukten ohne Phosphat war festzustellen. Der direkte visuelle Vergleich der Chargen 3, 4 und 5 ergab die größte Ähnlichkeit für das Vergleichspaar 4 und 5.
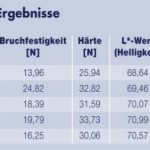
Tabelle 4 zeigt in der Übersicht die analytischen Ergebnisse zu den Endprodukten.
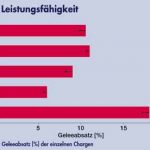
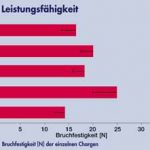
Eines der Hauptkriterien ist dabei der Geleeabsatz, wichtig insbesondere bei Dosenware, aber auch bei großkalibrigen Produkten. Die Leistungsfähigkeit des Lupinenproteins ist speziell bei diesem Parameter deutlich zu sehen. Im Vergleich zu den Produkten ohne Phosphat (Charge 1) bzw. mit Kaseinat (Charge 4) zeigt Charge 3 (mit Lupinenprotein) hier ein wesentlich höheres Retentionsvermögen. Abbildung 3 verdeutlicht diesen Sachverhalt und zeigt auch auf, dass bei Charge 1 ein Geleeabsatz in doppelter Höhe im Vergleich zu Charge 3 stattfand. Weiterhin zeigten die Messungen der Textur (Textur-Profil-Analyse, Probenhöhe 10mm, Durchmesser 12,3mm, T = 5 °C), dass mit allen zugesetzten Produkten im Vergleich zur Charge ohne Phosphat eine deutliche Steigerung der Bruchfestigkeit und der Härte gegeben ist. Abbildung 4 verdeutlicht dies. Die Ergebnisse von Charge 3 und 4 sind mit Einbeziehung der Standardabweichung überlappend und können somit als gleich gewertet werden.
Bei der Farbmessung wurden jeweils der L*-Wert (Helligkeit), der b*-Wert (Gelbton) und der a*-Wert (Rotton) aufgenommen. Deutliche Abweichungen waren bei diesen Parametern nicht zu beobachten, lediglich eine leichte Rotgelb-Verschiebung der Charge 3 im Vergleich zu Charge 4. Charge 5 zeigte, wie schon bei der visuellen Begutachtung beobachtet, beinahe gleiche Werte wie Charge 4.
Die Ergebnisse zeigen, wie das Lupinenprotein Vitaprot als ernährungsphysiologisch wertvolles Protein vorteilhaft in Wurstwaren eingesetzt werden kann. Insbesondere durch die technologisch Wirksamkeit und den im Vergleich zu Kaseinaten wesentlich günstigeren Preis wird Lupinenprotein in Zukunft in vielen Anwendungen, nicht nur im Fleichbereich, die Zutat der Wahl sein. Ein weiterer preislicher und technologischer Vorteil kann durch den Einsatz von Mischungen, wie im vorliegenden Beispiel mit Pulvercellulosen, erreicht werden. Aber auch 1 : 1 Mischungen mit Kaseinaten sind denkbar, um synergetische Effekte auszunutzen.
Stand E160
E dei 201
Unsere Whitepaper-Empfehlung
Flexibilität, Effizienz und Produktionssicherheit in der Teigherstellung steigern und Personalmangel ausgleichen. Wie Sie den Spagat mit smarter Automatisierung meistern, jetzt im E-Guide lesen.
Teilen: