Tierzellen unterscheiden sich von prokaryotischen Zellen in vielerlei Hinsicht. Sie weisen beispielsweise niedrigere Wachstumsraten und eine größere Empfindlichkeit gegenüber Scherkräften und Luftblasen auf. Diese Charakteristiken haben starken Einfluss auf die Konstruktion von Bioreaktoren. Bioengineering hat für diesen Anwendungsbereich spezielle Misch- und Belüftungssysteme entwickelt.
Abb. 2 Der Festbettfermenter eignet sich besonders für die Herstellung extrazellulärer Produkte in Langzeitkulturen
Abb. 3 Einsatz des Rotorfilters
Tierzellen unterscheiden sich von prokaryotischen Zellen in vielerlei Hinsicht. Sie weisen beispielsweise niedrigere Wachstumsraten und eine größere Empfindlichkeit gegenüber Scherkräften und Luftblasen auf. Diese Charakteristiken haben starken Einfluss auf die Konstruktion von Bioreaktoren. Bioengineering hat für diesen Anwendungsbereich spezielle Misch- und Belüftungssysteme entwickelt.
In Zellkulturen muss eine homogene Mischung gewährleistet sein. Nur so lassen sich Temperatur- und pH- Gradienten oder Gradienten von anderen Mediumsbestandteilen vermeiden. Gleichzeitig ist die Scherempfindlichkeit der Zellen in Betracht zu ziehen. Mechanisches Mischen erfolgt daher typischerweise mit Propellerrührern bei niedrigen Drehzahlen. Durch die Zellkulturtechnik auftretende Probleme der Durchmischung werden auch durch pneumatisches Mischen in Airliftfermentern oder hydraulisches Mischen mit externen Pumpen in Wirbelschichtreaktoren gelöst.
Um Schaumbildung zu vermeiden und zur Verhinderung von Zellschäden durch Luftblasen, kann die Begasung mit reduzierten Flussraten, durch Oberflächenbelüftung oder mit blasenfreier Belüftung durch Membranen erfolgen. Bei der Verwendung reduzierter Gasflussraten muss die Sauerstoffkonzentration im Belüftungsstrom erhöht werden. Gasmischstationen garantieren die optimale Versorgung mit Sauerstoff, Stickstoff, Luft und Kohlendioxid.
Batchweise oder kontinuierlich
Die Kultivierung von tierischen Zellen kann in Batch-, Fed-Batch oder kontinuierlicher Kultur mit und ohne Rückhaltung der Zellen erfolgen. Im Batchverfahren werden die Zellen ohne Zugabe von zusätzlichem Substrat nach der Inokulation kultiviert. Dabei kann die Produktivität durch Substratlimitierung oder die Bildung von toxischen Produkten reduziert werden. Um diese Probleme zu verringern, kann die Fed-Batch-Technik angewendet werden. Hierbei werden schrittweise Medium oder essenzielle bzw. limitierende Nährstoffe nach dem Beimpfen zur Fermentationsbrühe zugefügt. Bei kontinuierlichen Fermentationsverfahren entfernt man wachstumsinhibierende Produkte, wie zum Beispiel Laktat oder Ammoniak, fügt gleichzeitig frisches Medium hinzu, um Substratlimitierungen zu vermeiden. Limitierungen der Produktivität von Tierzellen sind meist auf die geringen Wachstumsraten zurückzuführen. Deshalb wird die kontinuierliche Kultivierung oft mit Zellrückhaltung durchgeführt (Perfusionssystem). Dies erlaubt höhere Zelldichten und gleichzeitig einen hohen Mediumsdurchsatz, die Produktivität wird somit wesentlich gesteigert. Die Zellrückhaltung wird mit geeigneten Filtrationssystemen wie Rotorfiltern oder Spiralfiltern durchgeführt.
Viele Säugerzellen wachsen nur, wenn sie an Oberflächen haften. Diese adhärenten Zellen werden auf Microcarriern, beispielsweise aus Glas, Zellulose, Dextran, Collagen, Gelatine oder Plastik, immobilisiert. Wird ein poröser Träger verwendet, können die Zellen auch innerhalb der Carrier wachsen. Dadurch sind sie verstärkt gegen Scherbeanspruchung geschützt, was höhere Drehzahlen und Belüftungsraten erlaubt.
Das Bioengineering-Programm umfasst eine Vielzahl von Reaktoren, die die speziellen Anforderungen für die Kultivierung von verschiedenen Zellkulturen erfüllen. Im Folgenden werden einige Beispiele herausgegriffen.
Zellfermenter
Der Rührkesselreaktor in Abbildung 1 ist speziell für die Kultivierung von Tierzellen konzipiert. Er ist als Pilot- oder als Produktionsfermenter mit einem Gesamtvolumen von bis zu 2000 l erhältlich. Um minimale Scherbeanspruchung zu erreichen, erfolgt die Durchmischung mit einem Propellerrührer. Der Fermenter kann im Chargen- (Batch-), im Fed-Batch-Verfahren und wegen der integrierten Wägezellen auch kontinuierlich betrieben werden.
Der Reaktor eignet sich für die Kultivierung von suspendierten Zellen genauso wie für Zellen, die auf Microcarriern immobilisiert werden. Für die Rückhaltung von Suspensionszellen in kontinuierlicher Kultur sind Rotorfilter und Spiralfilter erhältlich (siehe unten).
Ein geschlossenes Flaschenprobenahmesystem gewährleistet die sterile Probennahme von infektiösen Zellen (z. B. bei der Virusproduktion).
Je nach dem Sauerstoffbedarf der unterschiedlichen Zelllinien lassen sich verschiedene Belüftungssysteme wie Sparger, Oberflächenbegasung oder blasenfreie Begasung durch Silikonschläuche einsetzen. Dabei lässt sich auch die unterschiedliche Scherempfindlichkeit der Zellen berücksichtigen.
Festbettreaktor
Eine Alternative für adhärente Zellen bietet der Festbettreaktor in Abbildung 2. Hierbei sind die Microcarrier mit den Zellen als Festbett in einem durchgängigen Behälter eingeschlossen. Dieses System braucht keine Separationstechnik zur Entfernung des Permeats. Die Scherbeanspruchung und die Zellschädigung durch Gasblasen sind sehr klein.
Während der Kultivierung zirkuliert mit Sauerstoff angereichertes Medium durch das Festbett. Bei Festbettreaktoren mit axialem Fluss ist die Länge des Festbetts ein kritischer Parameter, da unter Umständen ausreichende Sauerstoff- und Nährstoffzufuhr nicht sichergestellt werden kann. Im großtechnischen Bereich kann dieses Problem durch radiale Durchströmung überwunden werden. Verbrauchtes Medium mit angereichertem Produkt kann batchweise oder kontinuierlich entfernt werden.
In Zusammenarbeit mit der Technischen Universität Hamburg-Harburg hat Bioengineering Festbetteinsätze für Laborfermenter entwickelt, das Scaling-up auf Festbettvolumen für Pilotgrößen ist möglich. Die Probleme des axialen Flusses treten in diesem Festbett nicht auf, die spezielle Konstruktion ermöglicht die radiale Durchströmung.
Festbettfermenter eignen sich für die Fermentation von immobilisierten Zellen und dabei besonders für die Herstellung extrazellulärer Produkte in Langzeitkulturen.
Filtersysteme
Beim Züchten von tierischen Zellen wird aus verschiedensten Gründen oft ein kontinuierlicher Kultivierungsprozess angestrebt. Wegen der langsamen Wachstumsraten sind aber die üblichen Konti-Kultivierungen nicht möglich. Sind die Zellen nicht in einem Festbett immobilisiert, müssen Lösungen gefunden werden, das Medium auszutauschen, ohne die Zellzahl zu reduzieren. Zu diesem Zweck lassen sich der Rotor- und der Spiralfilter einsetzen.
Rotorfilter
Der Rotorfilter (Abb. 3) basiert auf dem Prinzip des rotierenden Siebes. Ein oben und unten geschlossenes Drehsieb aus rostfreiem Stahlgewebe rotiert in der Kultivierungsbrühe, und zellfreies Medium wird durch das Sieb und die Hohlwelle abgezogen. Durch Optimierung der separat einstellbaren Rotorfilter-Drehzahl und der Durchflussraten gewährleistet der Rotorfilter eine exzellente Zellrückhaltung ( >80%) selbst in großem Maßstab und ohne Schädigung der Zellen.
Der Rotorfilter kann direkt in den Reaktor eingebaut und in-situ mit dem Fermenter sterilisiert oder alternativ auch als externes Bypass-System verwendet werden. Das Bypass-System kann für mehrere Fermenter eingesetzt und während der Kultivierung demontiert, gereinigt, sterilisiert und wieder angeschlossen werden [1].
Der Rotorfilter ist für alle Fermentergrößen, vom autoklavierbaren 3-l-Fermenter bis zum 1000-l-Produktionsfermenter erhältlich.
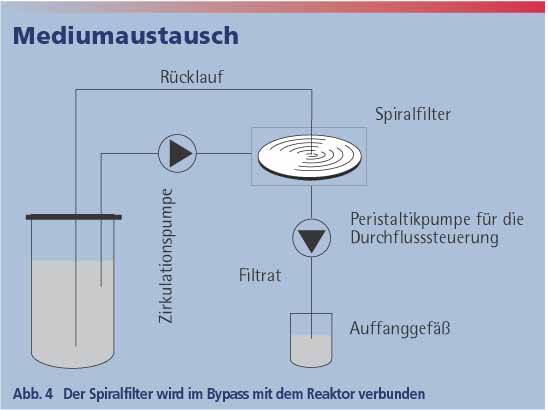
Spiralfilter
Der Spiralfilter basiert auf der Membrantrenntechnik (Abb. 4). Die Spiralkanäle mit den sekundären Fließeffekten ermöglichen hohe Durchsätze mit minimalem Energieverbrauch ohne Vorfiltration [2]. Der Spiralfilter wird mit dem Bioreaktor über ein Bypass-System verbunden und ist entweder in-situ sterilisierbar oder autoklavierbar. Wegen der geringen Scherkräfte eignet sich dieser Filter besonders für die Rückhaltung tierischer Zellen und für die zellfreie Probennahme.
Schrifttum
[1] Z. Sümeghy: Improved cell retention system based on the rotating sieve technique. Eine Kopie des Manuskripts ist bei Bioengineering erhältlich.
[2] H. B. Winzeler: Spiral stack membrane module. High performance low energy input membrane separation unit. Chimia 44, 1990, 288-291
Unsere Whitepaper-Empfehlung
Solida-Darreichungsformen: Vorteile und Grenzen verschiedener Batch-Granulier-Verfahren auf einen Blick. Treffen Sie mit dieser Entscheidungshilfe die richtige Wahl für Ihre Zielstellung.
Teilen: