Mit der Veröffentlichung der delegierten Verordnung (EU) Nr. 2016/161 am 9. Februar 2016 hat ein Gesetzgebungsprozess seinen vorläufigen Abschluss gefunden, der seit 2011 die Akteure der Arzneimittelversorgung in Deutschland beschäftigt hat. Pharmazeutische Unternehmen, Großhändler und Apotheker haben nun Klarheit. Doch die Zeit drängt.
Ab 9. Februar 2019 dürfen in Deutschland nur noch verschreibungspflichtige Arzneimittel in Verkehr gebracht werden, die spezielle Sicherheitsmerkmale tragen. Ziel der Fälschungsrichtlinie 2011/62/EU und der dazugehörenden delegierten Verordnung ist der Schutz des Patienten vor gefälschten Arzneimitteln in der legalen Lieferkette. Die EU-Kommission reagiert damit auf die Fälschungsfälle, die trotz der vorhandenen Regelungen und Kontrollen in den letzten Jahren immer wieder aufgedeckt worden sind. Diese Schutzmaßnahmen werden künftig durch verbindliche technische Lösungen, das individuelle Erkennungsmerkmal und die Vorrichtung gegen Manipulation ergänzt. Der Bundesverband der pharmazeutischen Industrie (BPI) und die anderen Verbände im deutschen Arzneimittelmarkt sind den Weg der EU-Kommission von Anfang an mitgegangen.
Die Akteure der Arzneimittelversorgung betrachten Patientenschutz als ein hohes Gut, das es zu verteidigen gilt. Deutschland soll weiterhin zu den weltweit sichersten Märkten für Arzneimittel gehören. Die Verbände und die Marktakteure investieren bereits jetzt erheblich in den Aufbau von Securpharm und nehmen hohe Investitionen zur Realisierung technischer Lösungen und die Umstellung unternehmensinterner Prozesse auf sich. In den vergangenen fünf Jahren hat der BPI erhebliche finanzielle Mittel und erhebliche personelle Ressourcen in dieses historische Projekt eingebracht. Schon jetzt gelten die Einführung von Securpharm und der neuen Sicherheitsmerkmale als das größte Infrastrukturprojekt der Arzneimittelversorgung in Deutschland.
Grundausrichtung bestätigt
Die deutschen Stakeholder haben sich frühzeitig auf die Umsetzung der Fälschungsschutzrichtlinie vorbereitet. Bereits 2011 haben sich die Verbände der pharmazeutischen Unternehmen, des Großhandels und der Apotheker zu Securpharm e. V. zusammengeschlossen, um technische und organisatorische Lösungen zur Umsetzung der Fälschungsschutzrichtlinie in Deutschland zu entwickeln. Seit 2013 ist Securpharm in der praktischen Erprobung und wird von immer mehr Marktteilnehmern genutzt.
Von Anfang an war die enge Begleitung durch eine repräsentative Gruppe an Marktteilnehmern jeder Handelsstufe ein essenzieller Teil der Entwicklung, um die Praktikabilität der Lösungen zu gewährleisten. Hier haben die Mitgliedsunternehmen mit ihrem starken Engagement eine ausgesprochen positive Rolle gespielt. Insgesamt bestätigt die delegierte Verordnung das Securpharm-System in den wesentlichen Grundpfeilern. Das System kann nun entsprechend der vorliegenden technischen und organisatorischen Anforderungen weiter ausgebaut werden.
Umsetzung durch Stakeholder-System
Wichtigste Bestätigung für Securpharm ist, dass der europäische Gesetzgeber den Aufbau der nationalen Systeme zur Überprüfung der Echtheit von Arzneimitteln an die Stakeholder (Artikel 35) der jeweiligen EU-Staaten adressiert und sich nicht für die Entwicklung eines behördlichen Systems entschieden hat.
Auch in anderen wesentlichen Eckpunkten sieht sich Securpharm durch den Inhalt der delegierten Verordnung bestätigt. Nach einer Folgenabschätzung und Abwägung der Kosten (Gründe 3) entschied sich die Kommission für die Echtheitsprüfung durch ein End-to-End-Überprüfungssystem, da damit im Vergleich zu dem deutlich teureren und aufwendigeren Track-and-Trace-System die Ziele der Echtheitsprüfung in gleich guter Qualität erreicht werden können. Diesen Ansatz hatte auch der BPI bei politischen Diskussionen auf europäischer Ebene und bei Securpharm verfolgt.
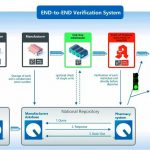
Beim End-to-End-System erzeugt der pharmazeutische Unternehmer bei der Fertigung des Arzneimittels das individuelle Sicherheitsmerkmal (Artikel 4), das am Ende der Lieferkette vom Apotheker bei der Abgabe an den Patienten auf seine Echtheit geprüft und ausgebucht wird (Artikel 25). Das End-to-End-System wird seitens der Großhändler durch risikobasierte Überprüfungen ergänzt. Unter risikobasierter Prüfung ist zu verstehen, dass der Großhandel da prüft, wo er ein Arzneimittel nicht vom pharmazeutischen Hersteller oder in dessen Auftrag erhält, etwa von einem anderen Großhändler oder als Retoure aus einer Apotheke (Artikel 20).
Data-Matrix-Code als Datenträger
Zusammensetzung, Format und Träger des individuellen Erkennungsmerkmals sind EU-weit vollständig harmonisiert. Das individuelle Erkennungsmerkmal wird im Data-Matrix-Code aufgebracht und enthält den Produktcode, eine Seriennummer, die Chargenbezeichnung und das Verfalldatum. Die als Produktcode verwendete PPN oder NTIN enthält die PZN, die für den Handel die relevante Artikelnummer bleibt und zur Kostenerstattung herangezogen wird. Eine zusätzliche nationale Kostenerstattungsnummer ist für Deutschland nicht erforderlich.
Die Fälschungsschutzrichtlinie (Art. 54a Abs. 3 der RL 2001/83/EG) und die delegierte Verordnung fordern (Art. 38 und Erwägungsgrund 37) bei der Überprüfung von Arzneimitteln unteranderem den im Unionsrecht vorgesehenen Schutz personenbezogener Daten und des Dateneigentums.
Securpharm basiert auf einem Konzept, bei dem durch den systemtechnischen Ansatz die Akteure Herr ihrer Daten bleiben. Die pharmazeutischen Unternehmen (pU) laden ihre packungsbezogenen Daten in das Datenbanksystem der pharmazeutischen Industrie (ACS-PU-System). Verifikationsanfragen der Apotheken werden über den Apothekenserver gebündelt und anonymisiert an das ACS-PU-System gerichtet. Diese Systemtrennung und die Anonymisierung der Verifikationsanfragen stellt die gegenseitige Vertraulichkeit der Daten vollständig sicher und belässt die Prozesse in den Händen der Verantwortlichen. Patientendaten werden an keiner Stelle erhoben.
Konkretisierung im Dialog
Die Vorgaben der delegierten Verordnung lassen Spielraum für deren Anwendung in allen 28 EU-Staaten und deren häufig durch nationale Besonderheiten geprägte Arzneimittelversorgung. Dies bedeutet einerseits Spielraum für die Auslegung, andererseits geht sie zu Lasten der Eindeutigkeit. Diese schaffen die Konsultationen der EU-Kommission mit den nationalen Behörden bzw. den nationalen Stakeholdern. Dieser Prozess erfordert eine intensive Auseinandersetzung mit dem Dokument seitens der Beteiligten aus den verschiedenen Blickwinkeln der einzelnen Verbände. Dabei gilt es, die Prozesse der Echtheitsprüfung mit ihren Auswirkungen bei allen Handelsstufen bis zum Patienten zu antizipieren.
Im Dialog mit den Marktteilnehmern und im Frage-Antwort-Wechselspiel mit den nationalen und internationalen Behörden soll eine möglichst hohe Klarheit und Übereinstimmung bei der Interpretation der einzelnen Artikel erreicht werden. Es ist davon auszugehen, dass es mehrere Konkretisierungsrunden mit den einzelnen Institutionen bedarf.
Herausforderungen für Unternehmen
Im Verlauf des Securpharm-Projektes sind verschiedene Herausforderungen deutlich geworden, die sich im Wesentlichen drei verschiedenen Gruppen zuordnen lassen und die für alle pharmazeutischen Unternehmen von wesentlicher Bedeutung sind – werden diese nicht gemeistert, steht die Lieferfähigkeit der Unternehmen ab 2019 grundsätzlich in Frage.
Das Sicherheitssiegel
Am 9.2.2016 steht durch die Veröffentlichung der delegierten Verordnung 2016/161 nunmehr fest, wie die technischen Details der in Deutschland und fast allen Mitgliedsstaaten der EU ab 9.2.2019 vorgeschriebenen Sicherheitsmerkmale aussehen werden. Dies bedeutet, dass die Unternehmen ihre Konfektionierungslinien mit Druckern und Kamerasystemen ausstatten müssen. Diese Systeme müssen so beschaffen sein, dass im Regelbetrieb die Leistung beziehungsweise Geschwindigkeit der Linien nicht oder nur geringfügig nachlässt. Für die Integration der benötigten Technik bedarf es der Unterstützung durch die entsprechenden Anbieter aus dem Maschinen- und Anlagenbau. Die Kapazitäten dort unterschreiten nach den Einschätzungen des BPI jedoch den Bedarf der pharmazeutischen Industrie. Vorteilhaft für die Hersteller ist, dass nahezu alle in Frage kommenden Dienstleister in den vergangenen Jahren bei der Betreuung der Teilnehmer am Securpharm-Projekt umfangreiche Erfahrungen sammeln konnten.
Erzeugen und Verwalten der Seriennummern
Das eigentliche Sicherheitsmerkmal ist die produktindividuelle Seriennummer, die der Data-Matrix-Code transportiert, da diese Nummer jede einzelne Packung zu einem Unikat macht. Somit steht fest, dass jedes Unternehmen, das nach dem 9.2.2019 Arzneimittel mit Sicherheitsmerkmalen ausstattet, spätestens dann in der Lage sein muss, randomisierte Seriennummern in großer Zahl erzeugen, verwalten und transferieren zu können.
Nahezu jedes bisher an Securpharm teilnehmende Unternehmen hat mit diesem Teil der Umsetzung die größten Probleme, wobei die auftretenden Schwierigkeiten individuell sind und in erster Linie von der jeweiligen IT-Infrastruktur der Firmen abhängen. Das ist auch einer der Gründe dafür, dass es kaum Standardlösungen am Markt gibt. Insgesamt ist das Erstellen, Verwalten und Bewegen der Seriennummern eine anspruchsvolle und fehlerintensive Aufgabe, die auch die wenigen Dienstleister mit immer neuen Schwierigkeiten konfrontiert.
Tamper-Verification-Features
Die EU-Fälschungsrichtlinie und die delegierte Verordnung 2016/616 fordert neben dem Individualisieren und Identifizieren einzelner Packungen auch das Anbringen eines zweiten Sicherheitsmerkmals auf jedem von der Richtlinie betroffenen Arzneimittel. Dabei handelt es sich um sog. Tamper-verification-features (auch tamper-evidence-seals oder anti-tampering-devices), die das unautorisierte und unbemerkte Öffnen einer Packung verhindern sollen. In der überwiegenden Zahl der Fälle erreichen die Hersteller dies durch das Verkleben von Faltschachteln, andere Lösungen sind jedoch ebenfalls möglich. Das Beschreiben dieser technischen Details war Gegenstand der Arbeit eines Europäischer Normungsausschusses, an dessen Ende die Veröffentlichung der Europäischen Norm EN 16679:2015. Die Normungsinitiative war vom BPI ausgegangen, die Erstellung der Norm wurde vom Bundesverband mit erheblichen finanziellen und personellen Mitteln unterstützt.
Mit dem praktischen Umsetzen der technischen Anforderungen ist jedoch nur eine gewisse Zahl von Firmen sicher vertraut, viele andere betreten in diesem Bereich Neuland. Hier müssen diese Unternehmen unter Umständen (wie auch bei den Druck- und Kamerasystemen) neue Anlagen in bestehende Linien implementieren, was nicht nur in zeitlicher Hinsicht eine Herausforderung darstellt, sondern auch in vielen Fällen mit einem Platzproblem einhergeht. Insgesamt bestehen im Markt hinsichtlich des zweiten Sicherheitsmerkmals deutlich weniger Erfahrungen als im Umgang mit Druck- und Kamerasystemen, nicht zuletzt auch deshalb, weil ein Erstöffnungsschutz nicht Bestandteil des laufenden Securpharm-Projektes ist.
Die Lieferfähigkeit steht auf dem Spiel
Nur Firmen, die bereits begonnen haben, sich mit den technischen und organisatorischen Herausforderungen, die mit dem Umsetzen der EU-Fälschungsrichtlinie verbunden sind, auseinanderzusetzen, haben aus heutiger Sicht eine Chance, zum Zeitpunkt des Inkrafttretens der delegierten Rechtsakte den Markt mit Ware zu bedienen, die diesen Forderungen entspricht. Somit befinden sich etliche Firmen in einem Dilemma, denn eigentlich hätten sie schon längst mit den Vorbereitungen beginnen müssen. Denn nicht nur der Aufwand für die Umsetzung in den Firmen ist enorm und vielschichtig – beginnend mit dem Umbau von Linien über das Validieren der Anlagen, dem Schulen des Personals, dem notwendigen Verändern/Erweitern der IT-Systeme bis hin zum Gestalten der Faltschachteln sind fast alle Bereiche eines Unternehmens betroffen.
Erschwert wird diese Situation aber dadurch, dass fast keine dieser Aufgaben ohne die Hilfe von externen Partnern zu lösen ist. Hier sind die Hersteller von Druck-, Kamera- und Verpackungsmaschinen wie auch die Anbieter von Softwarelösungen und nicht zuletzt die Faltschachtelhersteller zu nennen, die, insgesamt betrachtet, bereits jetzt teilweise ausgelastet sind. Wer erst jetzt beginnt, sich der Dienste dieser Anbieter zu versichern, kann nicht unbedingt davon ausgehen, dass er rechtzeitig die Unterstützung erhält, die er benötigt.
Die Annahme jedoch, dass der Gesetzgeber den Herstellern vor diesem Hintergrund weitere Übergangsfristen gewähren wird, ist nicht realistisch, da die drei Jahre zwischen der Publikation der delegierten Verordnung und deren Inkrafttreten bereits als eine solche Frist gelten.
Der Ausweg
Aus den genannten Gründen ist die sofortige Auseinandersetzung mit der Frage „Wie gestalte ich die Prozesse in meinem Unternehmen, um die Anforderungen der EU-Fälschungsrichtlinie zu erfüllen?“ alternativlos. Durch den Übergang des Securpharm-Projektes in den Regelbetrieb seit 2011 besteht für alle Unternehmen Deutschlands jederzeit und dauerhaft die Möglichkeit, am europaweit einzigen System teilzunehmen, das unter Alltagsbedingungen funktioniert und die Anforderungen der Fälschungsschutzrichtlinie erfüllt. Hier können Betreiber während der Übergangszeit bis 2019 Erfahrungen sammeln und so Lösungen finden, um ab 2019 gesetzeskonforme Ware herzustellen und den Markt damit zu versorgen.
www.prozesstechnik-online.deSuchwort: phpP116bpi
So arbeitet die Non-Profit-Organisation
Securpharm im Überblick
Securpharm baut in Deutschland das System zur Echtheitsprüfung von verschreibungspflichtigen Arzneimitteln auf, beschreibt die Regeln, organisiert die Vorgehensweise und sucht Lösungen für auftretende Konflikte. Letzteres schließt ein, dass Securpharm gemäß den Vorgaben der (noch zu definierenden) zuständigen nationalen Behörden ein Konflikt-Management-System betreibt, das jede Art von unerwarteten Ereignissen bei der Arzneimittel-Verifizierung protokolliert und zur Aufklärung beiträgt.
Zur Sicherstellung des Datenschutzes und einer effektiven Organisation der Prozesse arbeitet Securpharm mit getrennten Systemen für pharmazeutische Unternehmen auf der einen sowie Großhändlern und Apotheken auf der anderen Seite. Die pharmazeutischen Unternehmen laden ihre Daten in die Datenbank der pharmazeutischen Unternehmen. Betreiber dieser Datenbank ist ACS PharmaProtect GmbH, die von den Verbänden BPI, BAH und vfa gegründet und derzeit noch finanziert wird.
Der Apothekenserver, über den auch die Großhändler ihre Verifizierungsanfragen richten, wird von der Werbe- und Vertriebsgesellschaft Deutscher Apotheker mbH betrieben und derzeit noch finanziert.
Thomas Brückner
Amtierender Vorsitzender,Securpharm e.V.
Unsere Webinar-Empfehlung
Der Webcast MTP und modulare Produktion bietet eine einzigartige Gelegenheit, mehr über die aktuellen Entwicklungen bei MTP und in der modularen Produktion zu erfahren.
Chemie- und Pharmaproduktion braucht mehr Flexibilität
In der heutigen sich schnell wandelnden Welt stehen…
Teilen: