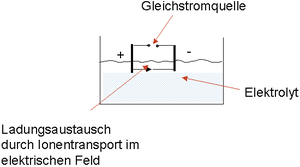
Auch: Elektrochemisches Element.
Begriff aus der Elektrochemie bzw. anwendungstechnisch aus der Galvanik. Die elektrochemische Zelle besteht aus zwei Elektroden, die in einen Elektrolyten eintauchen. Falls sie zur Erzeugung von elektrischem Strom dient, wird sie auch galvanische Zelle genannt.
Taucht man zwei Gegenstände aus verschiedenen Metallen so in einen Elektrolyten (leitende Flüssigkeit: wässrige Säure, wässrige Lauge, wässrige Metallsalzlösung etc.) ein, dass sie sich nicht berühren, tritt entsprechend der elektrochemischen Spannungsreihe zwischen den Gegenständen eine elektrische Spannung auf.
Verbindet man die Gegenstände außerhalb des Bades elektrisch leitend (mit einem Draht), fließt ein Strom. Gleichzeitig löst sich eines der beiden Metalle (das unedlere) langsam auf, wobei der Elektrolyt mit den Metallionen entsprechend angereichert wird, während das andere (das edlere) in der Regel weitgehend unverändert bleibt. Physikalischer Hintergrund ist, dass Atome des unedlen Metalls (Anode) ein oder mehrere Elektronen abgeben und als elektrisch geladene Ionen in Lösung gehen. Umgekehrt können auch Ionen aus der Lösung Elektronen aufnehmen und sich z. B. auf der Oberfläche der Kathode niederschlagen. Durch das Anlegen einer elektrischen Gleichspannung von außen an die beiden Pole der Elektroden kann ein solches System (Anordnung Anode / Kathode, welche über leitende Flüssigkeit / Elektrolyt verbunden sind) weitgehend beeinflusst werden. Je nach Zielsetzung kann aufgrund der aufgebrachten Spannung und dem dadurch verursachten Stromfluss im Elektrolyten durch gezielten Ladungsaustausch sowohl die Auflösung (In-Lösung-Gehen der Anode, elektrochemisches Polieren) als auch das Gegenteil davon (das Niederschlagen von Metallatomen auf der Kathodenoberfläche z. B. beim galvanischen Beschichten) erreicht werden. Im Elektrolyten wird dabei zwischen Anode und Kathode ein elektrisches Feld aufgebaut, das durch entsprechende Feldlinien gekennzeichnet ist.
Der Elektrolyt enthält infolge Dissoziation in wässriger Lösung Anionen (etwa SO4 2- bei wässriger Schwefelsäure als Elektrolyt) und Kationen (etwa H+). Durch das elektrische Feld beginnen sich die Ionen zu orientieren bzw. zu bewegen. Die Anionen sind negativ geladen und bewegen sich im Sinne der klassischen Elektrolyse zur Anode, während die Kationen zur Kathode wandern und dort ein Elektron übernehmen (2 H+ + 2 e– = H2 ↑), also wieder zum neutralen Atom bzw Molekül werden. Das Anion gibt an der Anode überschüssige Elektronen ab. Mit diesem Prozess ist der Ladungstransport infolge Ionenbewegung grundsätzlich erklärt.
Beim galvanischen Verchromen z. B. liegt das Werkstück am Minuspol einer Gleichspannungsquelle (Kathode), sodass Chromionen aus der Lösung dort Elektronen aufnehmen und sich als metallisches Chrom niederschlagen können. Umgekehrt liegt beim Elektropolieren das Werkstück am Pluspol (Anode), sodass Metallatome Elektronen abgeben und sich von der Oberfläche ablösen (kontrollierter Metallabtrag).
Beim Eloxalverfahren wird Aluminium in einem Elektrolyten aus wässriger Schwefelsäure als Anode geschaltet. Infolge der Anodisierung entsteht an der Anode Sauerstoff, der auf der Aluminiumoberfläche eine kontrollierte Schicht von Al2O3 wachsen lässt.
Zwischen der Zahl der ausgetauschten Elektronen (Strommengenfluss) und der Zahl der übergegangenen Metallatome (Materialabtrag bzw. Schichtbildung) besteht ein fester Zusammenhang über das Faradaysche Gesetz (Faradaysche Konstante), weil bestimmte Metallatome nur eine feststehende Zahl von Elektronen abgeben oder aufnehmen können, sodass die kennzeichnenden Paarungsgrößen Metall / Elektrolyt hinsichtlich der Definitionen Stromausbeute, Streuung, Stromdichte und elektrochemisches Äquivalent spezifisch sind. Daraus ergibt sich ein Zusammenhang zwischen der umgesetzten Materialmenge (Schichtabtrag beim Elektropolieren bzw. Schichtaufbau beim Galvanisieren) und der elektrischen Ladung. Die Ladung als Produkt von Stromstärke und Zeit ist eine Mengenangabe für transportierte Elektronen beim Materialumsatz des Prozesses und bestimmt das elektrochemische Äquivalent. Das elektrochemische Äquivalent erläutert den Zusammenhang zwischen Ladungsgröße und geometrischem Abtrag beim Elektropolieren bzw. geometrischem Schichtwachstum beim Galvanisieren. Über die angesprochenen technischen Verfahren hinaus finden elektrochemische Zellen und entsprechende Anordnungen vielfältige Anwendung für Messungen und Bestimmungen in Wissenschaft und Technik.
Abb. E 13: Schematische Darstellung einer elektrochemischen / galvanischen Zelle. (Quelle: G. Henkel)
© 2013 – ECV – Lexikon der Pharmatechnologie