Die zentrale Strategie, um die Covid-19-Pandemie möglichst bald hinter uns zu lassen, ist die Erreichung der Herdenimmunität mittels Durchimpfung der Bevölkerung. Im ersten Jahr der Pandemie waren die Entwicklung von Impfstoffkandidaten, deren Prüfung auf Wirksamkeit und Sicherheit in klinischen Studien sowie die Zulassung zum Markt die größten Herausforderungen für impfstoffentwickelnde Unternehmen. Diese Aufgaben wurden von mehreren Firmen im Rekordtempo gemeistert. Nun liegt die Herausforderung bei der Bereitstellung von ausreichend Impfstoffdosen.
Einbindung weiterer Produktionsstätten
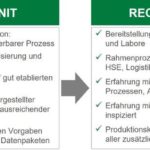
Produktionskapazitäten können am schnellsten durch einen Umbau in den zugelassenen Impfstoffproduktionsanlagen erhöht werden. Während des Umbaus kann allerdings die bestehende Anlage nicht für die Produktion genutzt werden, wodurch wiederrum die zeitgerechte Versorgung behindert wird. Daher bleibt als wesentliches Instrument die Einbindung weiterer Produktionsstätten innerhalb oder außerhalb des Unternehmens. Dies wird über Prozesstransfers erreicht, bei dem der Prozess von einer „Sending unit“ zu einer „Receiving unit“ transferiert wird.
Für einen raschen und erfolgreichen Transfer ist in erster Instanz die Wahl eines geeigneten Partners oder einer Contract Development and Manufacturing Organisation (CDMO) entscheidend. Dabei spielen das Vorhandensein geeigneter Herstellanlagen und Labore eine wesentliche Rolle sowie die Erfahrung des CDMOs mit biotechnologischen Produktionsprozessen. Know-how in der Umsetzung der entsprechenden regulatorischen Anforderungen sowie ein etabliertes und funktionierendes Qualitätssystem ermöglichen zudem die schnellere Integration eines neuen Prozesses. Neben der zeitlichen Verfügbarkeit der Herstellanlagen ist es wichtig, dass die insgesamt vorhandene Produktionskapazität des CDMO groß genug ist, um die Anzahl von Transfers und damit die organisatorische Arbeitslast niedrig zu halten.
Fokus auf alle Ressourcen
Das sendende Unternehmen trägt ebenso gewichtig zum schnellen und effizienten Transfer bei. Der Herstellprozess muss robust sein, damit er gut standardisierbar ist. Darüber hinaus erlaubt eine CMC- und Transferstrategie mit entsprechend vorhandenem Dokumentationspaket den vollen Fokus aller Ressourcen auf die technische Umsetzung, wodurch Strategiediskussionen und langwierige Entscheidungsprozesse vermieden werden. Ein jeder Transfer muss darüber hinaus risikobasiert gemäß ICH Q9 aufgesetzt werden – risikobasierte Entscheidungen können, sofern gut begründet, Projekte stark beschleunigen.
Bei Neubauten und komplexen Prozessen kann ein Prozesstransfer Jahre in Anspruch nehmen. Geschwindigkeit ist jedoch gerade in Hinblick auf Covid-Impfstoffe ein zentrales Credo und Standardisierung ist hierbei das Schlüsselwort: Die Herstellprozesse für mRNA basierte Impfstoffe sind sowohl hinsichtlich des Herstellprozesses als auch der begleitenden Analytik gut standardisierbar. So mancher CDMO bezeichnet seinen Plattformprozess sogar als plug-and-play-Verfahren. Die einzelnen Verfahrensschritte greifen auf bewährte Teilschritte zurück und werden modular aneinandergefügt.
Produktionskapazitäten erweitern
Standardisierung führt aber wiederum auch zu Versorgungsengpässen und in Folge zu Verzögerungen. Für Schlüsselmaterialien wie Nucleotide und Singe-Use-Materialien sind die Märkte weitgehend erschöpft. Hier wird seitens der Lieferfirmen als auch unter Einbeziehung der regulatorischen Behörden bereits streng priorisiert. Auch Vertragslabore mit entsprechender GMP-Analytik können mittlerweile nur mehr unter Vorlaufzeiten von vielen Monaten agieren. Der Prozesseigentümer kann dem CDMO eine wertvolle Starthilfe bieten, indem er knappe Rohstoffe bereitstellt oder Laborkapazitäten organisiert. Wenn alle beschleunigenden Aspekte zusammenspielen, können Vorlaufzeiten für den Start der kommerziellen Produktion als auch der analytischen Methoden auf wenige Monate reduziert werden. Damit ist es möglich die Produktionskapazitäten in 2021 um ein Vielfaches zu erweitern.
Das komplexe und effiziente Zusammenspiel ist allerdings nicht nur notwendig um derzeit ausreichend Impfstoff gegen Sars-CoV2 zur Verfügung zu stellen, sondern auch um die Prozesse in Hinblick auf Sars-CoV2-Varianten rasch adaptieren zu können.
Mit dem richtigen Partner die Expertise ausbauen
Wenn Kompetenz, Erfahrung und Humanressourcen innerhalb des Unternehmens nicht ausreichen, kann auch ein erfahrener Partner/Supplier die Abwicklung eines Tech Transfers massiv beschleunigen und zum Erfolg beitragen. Gerade wenn der Partner viel Erfahrung in Transfers, insbesondere von ähnlichen Prozessen und Molekülen mitbringt und sowohl auf strategisches Knowhow als auch Detailkompetenz in den einzelnen Bereichen wie Prozess, Analytik, Transfers und Validierungen zurückgreifen kann.
VTU Group GmbH, A-Grambach