Beim Thema „Outsourcing von Labordienstleistungen“ werden viele Mitarbeiter des technischen Managements zurecht sagen: „Das ist doch eher ein Thema für unsere Qualitätskontrolle.“ Fakt ist allerdings, dass es viele Schnittstellen direkt in die Pharmaproduktion gibt. Welche das sind und wie sich die Zusammenarbeit mit einer Contract Service Organization (CSO) gestaltet, wird im Folgenden skizziert.
Die Autoren: Birgit Schumacher, Christof Siersdorfer, Martin Liebig, Hildegard Brümmer, Andreas Zumdick, SGS Institut Fresenius Life Science Services
Enthält die Produktionsanlage Filter? Werden Druckluft oder andere Gase bei der Produktion eingesetzt? Wird in der Produktion Wasser unterschiedlicher Qualitäten gebraucht? Viele Fragen, auf die sich ein Life-Science-Dienstleister wie SGS Institut Fresenius einstellen muss. Die vielfältigen Ansprüche, die es zu erfüllen gilt, reichen von der Rolle als Überlaufpartner bei Produktionsspitzen über die Wahrnehmung als Anbieter von Spezialuntersuchungen bis hin zum Partner für die komplette Auslagerung der Qualitätskontrolle. SGS Institut Fresenius ist mit zwei Laborstandorten für R&D/QC-Testung in Berlin und Taunusstein vertreten und kann auf weitere Spezialanalytik aus dem weltweiten Netzwerk der SGS mit ihren 17 Laborstandorten innerhalb von Life Science Services zurückgreifen.
Aufwendige Studien auslagern
Werden zum Beispiel in einer pharmazeutischen Produktionsanlage für Injectabilia, Impfstoffe und Plasmaprodukte Filter benutzt, so ist es im Rahmen der Zulassung notwendig, dass sogenannte Extractables- und Leachables-(E&L)-Studien durchgeführt werden, um Informationen darüber zu erhalten, ob und welche Substanzen im Herstellungsprozess aus den Filtern in das Produkt übergehen können und ob diese Substanzen den Patienten potenziell schädigen können.
Für die erfolgreiche Durchführung von E&L-Studien ist ein entsprechendes Know-how notwendig und es werden spezielle Analysegeräte benötigt, wie sie in vielen firmeneigenen Qualitätskontrolllaboren häufig nicht vorhanden sind. Auch sind die Projekte mit einem sehr hohen Zeit- und Personalaufwand verbunden, sodass neben dem normalen Laborbetrieb oft keine Kapazitäten für die Durchführung dieser Studien bleiben.
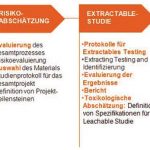
Es handelt sich bei den E&L-Projekten um einen mehrstufigen Prozess, der mit dem Extractable-Teil Forschung und Entwicklung und mit dem Leachable-Teil hingegen GMP-konforme Routine enthält. Bild 2 zeigt eine schematische Darstellung für die Durchführung einer E&L-Studie. Das Vorgehen lässt sich folgendermaßen beschreiben: Nach einer Risikobewertung der eingesetzten Filtermaterialien erfolgt die Extractable-Studie. Hier wird eruiert, welche Stoffe sich aus den eingesetzten Filtern in Anwesenheit von diversen Lösemitteln lösen. Die gefundenen Substanzen müssen einer toxikologischen Bewertung unterzogen werden. Aus dieser Bewertung werden die Parameter für die Leachables-Studie bestimmt, wobei bei Letzterer untersucht wird, inwieweit die toxikologisch bedenklichen Substanzen in das Produkt migrieren. Nach Entwicklung und Validierung der Methoden für die Leachables-Studie werden die Leachables routinemäßig während der Produktionsphase kontrolliert.
Übernahme von Kontrollaufgaben
In den Bereich der Wareneingangskontrolle für die Produktion gehören die Testungen von Primärpackmitteln, sogenanntes Container Testing. Diese werden routinemäßig entsprechend der Pharmakopöen (Ph. Eur., USP und JP) durchgeführt und geraten in letzter Zeit verstärkt in den regulatorischen Fokus. Auch in diesem Fall können CSOs beauftragt werden, da Letztere häufig das Container Testing bereits routinemäßig in ihren Laboren implementiert haben, was eine kosten- und zeitnahe Durchführung dieser Untersuchungen gewährleistet.
Ebenfalls stellt die Kontrolle von Produktionsgasen eine nicht alltägliche Prüfung für das Qualitätskontrolllabor des pharmazeutischen Herstellers dar. Gase für die Produktion können selbst produzierte Druckluft oder das vom Gashersteller gelieferte hochreine Gas sein, welches durch die hauseigenen Leitungen zum Produktionsort geführt wird. In beiden Fällen müssen die eingesetzten Gase als Herstellungsmedien betrachtet werden und der Hersteller hat entsprechend der Pharmakopöen die Qualität und Reinheit der Gase am „Point of use“ zu gewährleisten. Die Gehalt- und Spurenanalytik von Gasen ist gemäß der Vorschriften der Pharmakopöen anspruchsvoll und geräte-technisch aufwendig. Da die Überprüfung nach einer intensiven Qualifizierungsphase zwar regelmäßig, jedoch nicht sehr häufig stattfindet, ist die Beschaffung kaum rentabel und die Zusammenarbeit mit einer CSO kann eine ökonomisch und qualitativ sinnvolle Alternative sein. Der größte Teil der notwendigen Analysen kann direkt vor Ort mit mobilen Geräten durchgeführt werden. Die Proben für die Analysen, die im Labor durchgeführt werden müssen, werden vor Ort gezogen und zeitnah im Labor untersucht.
Wasser für die pharmazeutische Herstellung wird teilweise bereits online überprüft (Leitfähigkeit und TOC). Für eine ganze Reihe von Parametern (u.a. Mikrobiologie) ist dies kaum möglich, sodass weiterhin ein Analysenlabor notwendig ist. Wer seine Produkte weltweit vertreibt, muss unter Umständen auch gemäß Vorschriften prüfen (Japanische Pharmakopöe), deren Methoden nicht mit USP und Ph. Eur. harmonisiert sind. Hierbei kann eine CSO, die diese Methoden bereits validiert hat, eine sinnvolle Ergänzung sein. Das externe Labor sollte hierbei logistische Unterstützung wie z. B. Probentransport, geeignete qualifizierte Transportbehältnisse und vorbereitete Probeflaschen zur Verfügung stellen können.
Der erste Schritt für eine erfolgreiche Zusammenarbeit ist die Suche nach dem richtigen Partner. Soll es ein einzelnes Labor sein oder ein Laborverbund? Soll ausschließlich auf lokaler Ebene kooperiert werden oder sollen für die Zukunft globale Optionen gegeben sein? Welche Turn-Around-Times und welches Preis- Leistungs-Verhältnis wird seitens des Auftraggebers erwartet?
Zusammenarbeit implementieren
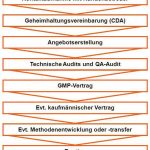
In Bild 3 ist der Ablauf der Implementierung einer Kooperation schematisch dargestellt. Die erste Kontaktaufnahme mit der CSO erfolgt im Allgemeinen über dessen Kundenbetreuer. Nach dem Abschluss einer beidseitigen Geheimhaltungserklärung (CDA) und dem Austausch der notwendigen Informationen kann ein passendes Angebot erstellt werden. Einer Beauftragung vorangeschaltet sind häufig technische Audits sowie das QA-Audit, mit dem das Qualitätsmanagement vor Ort überprüft wird. Entscheidet sich der Kunde für einen Partner, so wird entsprechend der EU-GMP-Richtlinien ein Verantwortungsabgrenzungsvertrag (sog. GMP-Vertrag) geschlossen. Hierin werden die Rechte und Pflichten beider Seiten klar geregelt, z. B. das OOS-Prozedere, die Archivierung der Rohdaten und die Verantwortung für die Freigabe nach §13 Arzneimittelgesetz (AMG). In Ergänzung zum GMP-Vertrag kann optional ein kaufmännischer Vertrag geschlossen werden, in dem z. B. Preise, Haftungsfragen und die Zahlungskonditionen geregelt werden. Nach Abschluss des GMP-Vertrags kann je nach Beauftragung mit dem Methodentransfer, mit der Methodenentwicklung oder direkt mit der Routineanalytik von feststehenden allgemeingültigen Prüfvorschriften begonnen werden.
Online-Info www.pharmaproduktion.com/0111439
Unsere Webinar-Empfehlung
Der Webcast MTP und modulare Produktion bietet eine einzigartige Gelegenheit, mehr über die aktuellen Entwicklungen bei MTP und in der modularen Produktion zu erfahren.
Chemie- und Pharmaproduktion braucht mehr Flexibilität
In der heutigen sich schnell wandelnden Welt stehen…
Teilen: