Der neue Katalysator ist ein Silikon-Material, das die Likat-Chemiker mit unterschiedlichen Fluoreszenzfarbstoffen versetzen: gelb, grün, rot oder blau. „Da jede Farbe zu einer bestimmten Wellenlänge im Lichtspektrum gehört, können wir damit wunderbar den Energiebereich bestimmen, in dem der Katalysator aktiv werden soll“, erläutert Dr. Esteban Mejíía, Forschungsleiter für Polymere und Katalyse am Likat.
Die Überwachung von Pumpen in industriellen Prozessen ist weit mehr als eine reine Schutzmaßnahme für das Pumpenaggregat. Neben der präventiven Wartung und...
Metallfrei und milde Reaktionsbedingungen
„Aktiv werden“ heißt hier vor allem: Der Photokatalysator absorbiert aus dem Licht Photonen, deren Energie er an die Reaktionspartner weitergibt, und zwar exakt im Energiebereich der jeweiligen Farbe, mit der er versetzt wurde. Auf diese Weise können Chemiker Ausgangsstoffe so präzise aktivieren, dass sie ausnahmslos mit den gewünschten Reaktionspartnern neue chemische Bindungen eingehen und dabei kaum Nebenprodukte erzeugen.
Im Unterschied zu üblichen Prozessen der organischen Chemie verfügt das neue Katalysatorsystem über entscheidende Vorteile. Es arbeitet bei Raumtemperatur und Atmosphärendruck, also unter ungewöhnlich milden Bedingungen, wie Mejíía sagt. „Außerdem enthält der Katalysator keine Metalle. Und er kann leicht zurückgewonnen werden.“
Der Katalysator ist ein Silikon-Derivat namens Poss, er besteht aus organischen und anorganischen Bausteinen, weshalb Chemiker ihn als hybrid bezeichnen. Charakteristisch für das Material ist eine Art Rückgrat aus Sauerstoff-Silizium-Sauerstoff-Bindungen. Dr. Mejíía: „Das macht den Katalysator thermisch und chemisch sehr stabil.“ Sauerstoff und Silizium sind die beiden häufigsten chemischen Elemente der Erdkruste.
Poren als Reaktionsraum
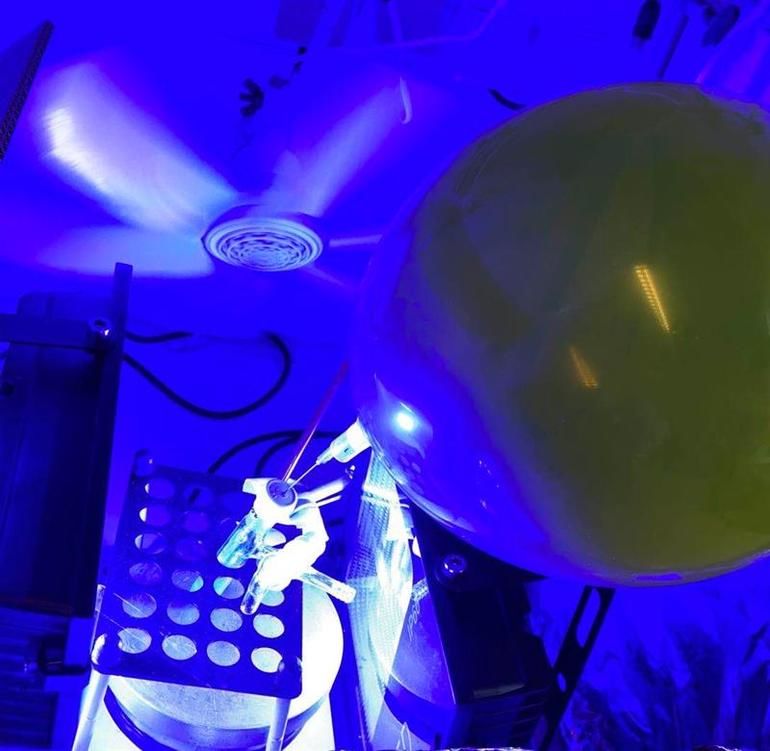
Poss ist hochporös und damit ideal für die Katalyse. „Die Poren bieten geeignete Nischen, in denen sich angeregte Ausgangsstoffe nahe genug kommen, um miteinander zu reagieren“, sagt Mejíía. Auch ästhetisch spricht der Katalysator an: Unter Lichteinwirkung beginnt er in den jeweiligen Farben, die ihm beigegeben wurden, zu fluoreszieren.
Die Idee, farbige Poss als Katalysatoren zu nutzen, kam Mejíía vor drei Jahren. Damals hatte Dengxu Wang, ehemaliger Postdoc, in seiner Gruppe Sensoren zum Nachweis von nitroaromatischen Sprengstoffen, Metall-Ionen und toxischen Gasen entwickelt, und zwar auf Basis angeregter fluoreszierender Polymere. Dengxu Wang gab den Polymeren einen Farbstoff entsprechend der nötigen Wellenlänge für den gesuchten Schadstoff bei. Sobald die Polymere Moleküle dieser Substanz aufspüren, hören sie auf zu leuchten. Mejíía vermutete schon damals, dass sich auf diese Weise Moleküle nicht nur detektieren, sondern auch chemisch aktivieren lassen. „Mit solch einer farblich gesteuerten modularen Funktion könnten wir sozusagen einen chemischen Lego-Baukasten entwickeln, aus dem wir uns Katalysatoren zusammenstellen.“
Modellreaktion: C-H-Derivatisierung
Die Photokatalysatoren entstanden dann in China, im Labor von Dengxu Wang, der inzwischen an die Universitäät Shandong berufen wurde. In Rostock entwickelte Mejíías Doktorandin Xuewen Guo die Modellreaktion dafür samt Tests und Analysen. Als Modell diente ein Prozess aus der organischen Synthese. Und zwar sind in organischen Verbindungen meist Kohlenstoffatome an Wasserstoffatome gebunden. Diese C-H-Bindungen werden in Zwischen- und Endstufen für Produkte etwa der Pharma- und Agrochemie zu Kohlenstoff-Bindungen (C-C) umgewandelt.
Ein wichtiger Schritt ist dabei die C-H-Derivatisierung, um die Moleküle chemisch zu aktivieren, wie Dr. Mejíía erlääutert. Hier setzt das neue Verfahren ein. Üblicherweise braucht es für das Aufbrechen der C-H-Bindung ein Metallatom, das vom Katalysator bereitgestellt wird. Der neue Photokatalysator aus dem Likat enthält aber keinerlei Metall. Die Forscher setzten stattdessen auf seine hochporöse Struktur. „Wir wussten außßerdem, dass unser Material gut mit Sauerstoff reagiert.“ Und den benötigt die Reaktion als Oxidationsmittel.
Photonen als Energieüberträger
Tatsächlich funktioniert die Reaktion, und inzwischen ist den Chemikern auch der Ablauf klar. „Der Katalysator absorbiert ein Photon und überträgt es an den Sauerstoff“, erläutert Dr. Mejíía. „Dabei bildet sich ein superreaktives Sauerstoff-Teilchen, ein sogenanntes Singlet Oxygen.“ Dieser energiereichen Spezies gelingt es, die Moleküle der organischen Ausgangsstoffe anzugreifen, somit zu aktivieren und für die nächsten Schritte vorzubereiten. Im Labor gelang dieser Vorgang am besten, wenn die Proben mit blauem Licht bestrahlt wurden. Auch der Katalysator wurde mit einem blauen Fluoreszenzfarbstoff versetzt.
Am Ende spart diese Vorgehensweise eine komplette Reaktionsstufe ein. Die Arbeit wird gewissermaßen in einem Schritt erledigt: Ausgangsstoffe aktivieren und derivatisieren sowie die Derivate mit speziellen Funktionen versehen. Das verbessert die ökologische Bilanz solcher Prozesse.