-
Elektrische Dipole.
Polarisierung elektrischer Ladungen bei Molekülen; hinsichtlich des molekularen Aufbaus von Stoffen eine elektronegative Asymmetrie in einer Verbindung aus elektrisch grundsätzlich neutralen Atomen (Bohr-Rutherfordsches Atommodell).
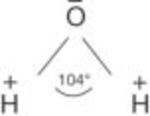
Beispiel Wasser: +H − O– − H+, wodurch für das Molekül eine typische elektrische Dipolsituation entsteht, weil das Sauerstoffatom hinsichtlich beider Wasserstoffatome deren Elektronen weitgehend „übernimmt” und damit die Wasserstoffatome eine positive Teilladung bekommen (siehe Abb. D 16).
Dipole verursachen bei Molekülen polare Strukturen, welche z. B. hydrophil oder lipophob wirken.
-
Mechanische Dipole.
In der technischen Mechanik die Bildung von Momenten, die bei der festigkeitsmäßigen Auslegung von technischen Konstruktionen neben Kraftwirkungen eine wesentliche Rolle spielen.
Abb. D 16: Darstellung der Dipolwirkung eines Wassermoleküls. (Quelle: G. Henkel)
© 2013 – ECV – Lexikon der Pharmatechnologie