Auch: Zunder.
Chemische Verbindung aus Eisen und Sauerstoff mit einer Dichte von 5,1 kg/dm3. Eisenoxid erscheint in drei Formen: als Eisen(II)-Oxid FeO (Wüstit, Smp. 1.420 °C), als Eisen(II,III)-Oxid Fe3O4 (Magnetit, Smp. 1.538 °C) und als Eisen(III)-Oxid Fe2O3 (Smp. 1.565 °C) mit den Modifikationen α-Fe2O3 (Wüstit), β-Fe2O3 und γ-Fe2O3.
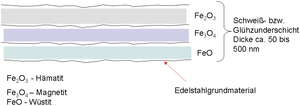
Eisen hat neben dem unedlen chemischen Charakter auch die chemische Eigenschaft, sowohl zwei- als auch dreiwertig zu sein. Speziell bei der Erhitzung von Edelstahllegierungen in Luftatmosphäre (z. B. Glühen > 500 °C bzw. beim Schweißen in der Hitzeeinflusszone) bilden sich in der Regel je nach Sauerstoffangebot alle 3 Eisenoxidformen. Die relativ dichte Deckschicht der Zunderschicht besteht aus Fe2O3 als typischem Eisen(III)-Oxid in rötlicher Form und hat ein verhältnismäßig schlechtes Säurelösungsverhalten (Beizreinigung durch chemisches Beizen).
Die 2. Lage besteht aus grau-blauem und lockerem, leicht porigem Fe3O4 (Fe(II/III)-Oxid), das merklich bessere Säurelösungseigenschaften aufweist und als 3. Schicht vor dem Grundmaterial lässt sich FeO als typisches Eisen(II)-Oxid mit recht guten Säurelösungseigenschaften detektieren, wobei FeO schon deutlich porig bzw. in lockeren Schichten auftritt.
Abb. E 7: Schematische Darstellung des Aufbaus der eisenoxidischen Anlauffarbenschicht in der HEZ einer austenitischen Edelstahloberfläche beim Schweißen. (Quelle: G. Henkel)
Die Löslichkeit der Eisenoxide in Säuren ist speziell beim fachgerechten chemischen Beizen von eisenoxidischen Zunderschichten von Bedeutung. Nachdem im Bereich der eisenoxidischen Zunderschichten die Passivschichtausbildung (Passivschicht) extrem gestört ist bzw. nicht mehr vorliegt, ist die Entfernung der Zunderschicht und die Repassivierung der gereinigten Edelstahloberfläche von fundamentaler Bedeutung für die Korrosionssicherheit (Korrosion) der Edelstahloberfläche.
© 2013 – ECV – Lexikon der Pharmatechnologie