Siehe auch: Korrosion.
Korrosionsprozesse verlaufen meist nach den Mechanismen der Elektrolyse. Auflösende Anode und umgebende Kathode bilden mit dem verbindenden Elektrolyten einen Korrosionsstromkreis.
Die wesentlichen (lokalen) Korrosionseffekte (Korrosionsformen) bei austenitischen Edelstahllegierungen basieren auf elektrochemischen Prinzipien der Elektrolyse aufgrund wässriger Elektrolyten mit oder ohne äußere Stromquelle (elektrisches Potenzial).
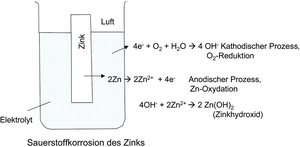
Abb. K 14: Schematische Darstellung eines chemischen Korrosionsstromkreises. (Quelle: G. Henkel)
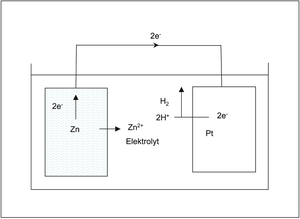
Abb. K 15: Beispiel einer Korrosionskurzschlusszelle. (Quelle: G. Henkel)
Intakte Edelstahloberflächen mit ungestörter chromoxidreicher Passivschicht haben die Eigenschaft eines typischen Halbleiters: Die Passivschicht lässt Elektronen problemlos passieren, sperrt allerdings Ionen, sodass ein Korrosionsvorgang, der grundsätzlich (Metall-)Ionen produziert und (in Lösung) abtransportieren muss (Stoff-Umsatz als kennzeichnende Größe), nicht ablaufen kann (passive Edelstahloberfläche).
Durchbricht nun etwa ein Cl–-Ion die Passivschicht, ist exakt an dieser Stelle der (lokale) Korrosionsstromkreis geschlossen. Durchbruchstelle: (sich auflösende) Anode mit Ionentransport als Ladungstransport; Passivschichtumgebung: Kathode mit entsprechendem Elektronentransport bzw. Elektronen- bzw. Ladungsaustausch.
Beispiel: Fe → Fe2+ + 2 e–
Fe2+ als Kation von der Anode abgehend bzw. im Elektrolyt in Lösung gehend; 2 e– als Anionen.
Die zerstörende Korrosion mit entsprechendem Stoffumsatz (lokale Auflösung des Metalls) kann aus elektrochemischer Sicht ungestört ablaufen, solange die Umgebungsbedingungen der anodischen Auflösung unverändert bleiben.
© 2013 – ECV – Lexikon der Pharmatechnologie