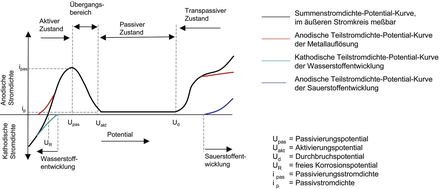
Graphische Darstellung des Verhältnisses der Stromdichte zum elektrischen Potenzial bei einer potentiodynamischen Elektrolyse einer Blechprobe aus austenitischer Edelstahllegierung in einem geeigneten Elektrolyten unter Zuhilfenahme einer externen Gleichstromquelle. Beispielsweise zeigt 1.4404 in verdünnter Schwefelsäure (0,5-m) bei steigender positiver Spannung (Potenzial) im Gleichstromkreis an der Probe den typischen Verlauf aktiver Bereich, passiver Bereich und transpassiver Bereich und erlaubt die Festlegung der kennzeichnenden Strom- und Spannungsgrößen, wie
-
Freies Korrosionspotenzial (Ruhepotenzial),
Die Kenntnis dieser Größen / Bereiche ist von fundamentaler Bedeutung für die Beurteilung des Korrosionsverhaltens (Korrosion) des Werkstoffes im Praxiseinsatz unter bestimmten Bedingungen.
Stromdichtepotenzialkurven verschiedener austenitischer Edelstahllegierungen in verschiedenen Medien bzw. mit unterschiedlichen Medienparametern können von einschlägigen Versuchsanstalten beschafft werden und dienen als Basis für konkrete korrosionstechnische Beurteilungen und Prognosen. Üblicherweise werden Stromdichtepotenzialkurven sowohl bei steigenden wie auch bei fallenden elektrischen Spannungen aufgenommen, wobei in der Regel keine kongruenten Stromdichtewerte ermittelt werden. Diese sogenannten Hystereseerscheinungen sind von Fall zu Fall bzw. Kombination zu Kombination betreffend Werkstoff und Elektrolyt zu prüfen.
Da Stromdichtepotenzialkurven den elektrochemischen Verhaltenscharakter von z. B. austenitischen Edelstahllegierungen im aktiven (unedlen), passiven (edlen) und transpassiven Bereich zeigen, werden sie zur Erklärung typischer Korrosionseffekte wie
-
flächige Korrosion (aktive Auflösung) unter Wasserstoffentwicklung,
-
Spannungsrisskorrosion im Passivbereich (Lokalkorrosion),
-
Lochfraßkorrosion im Passivbereich (Lokalkorrosion),
-
transpassive Auflösung unter Stauerstoffentwicklung
herangezogen.
Diese Prüfungen im Labor sind jedoch i. Allg. sehr aufwendig, sodass sich ergänzend entsprechende vereinfachte normierte chemische Prüfverfahren etabliert haben, die den jeweiligen Potenzialbereichen des Werkstoffs zugeordnet werden können:
-
aktiver Bereich (auf flächige Korrosion bzw. interkristalline Korrosion):
-
-
chemischer HNO3-HF-Test, ASTM A 262; Practise D,
-
chemischer Strauss-Test, ASTM A 262–93, Pr. E, F., DIN 50914, SEP 1877 I;
-
-
passiver Bereich (auf Lokalkorrosion wie z. B. interkristalline Korrosion):
-
-
chemischer Streicher-Test, ASTM A 262–93, Pr. B, SEP 1877 II,
-
chemischer Huey-Test, ASTM A 262–93; Pr. C, DIN 50921;
-
-
transpassiver Bereich (auf flächige Korrosion bzw. interkristalline Korrosion):
-
-
elektrochemischer Oxalsäuretest, ASTMA 262-93; Pr. A.
-
Abb. S 24: Summen- und Teilstromdichte-Potenzial-Kurven eines nicht-rostenden Stahls in Schwefelsäure (schematisierte Darstellung mit starker Verzerrung der Stromdichte: ip ist um mehrere Zehnerpotenzen niedriger als ipas). (Quelle: G. Henkel)
© 2013 – ECV – Lexikon der Pharmatechnologie