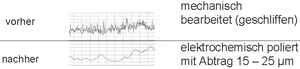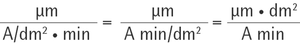Auch: Elektrochemischer Polierabtrag.
Materialabtrag von Oberflächen – insbesondere Edelstahloberflächen – durch kontrollierte selektive Auflösung der Oberflächenpartien nach dem elektrochemischen Prinzip (Elektrochemisches Polieren), indem Atom um Atom durch Ionisierung in Lösung geht und dabei den Materialverbund der Metalloberfläche verlässt.
Die Geschwindigkeit der Materialauflösung wird bei Konstanz aller übrigen Größen von der lokalen Stromdichte bestimmt. Da aus mikroskopischer Sicht auf Materialspitzen der Oberfläche höhere Stromdichten vorliegen als in Materialtälern, werden Spitzen stärker (rascher) abgetragen als Täler, sodass im Laufe des Gesamtabtrages von z. B. 20 µm auch eine entsprechende Einebnung des Mikrogefüges (Glättung) erfolgt. Der elektrochemische Abtrag nach diesen (selektiven) Gesetzmäßigkeiten wird je nach Vorbearbeitungszustand i. Allg. im Bereich zwischen 5–50 µm (üblicher Bereich 12–20 µm) vorgenommen, um entsprechend optimale, funktionale Eigenschaften der Edelstahloberfläche hinsichtlich Topographie, Morphologie, und Energieniveau zu erzielen. Der elektrochemische Abtrag erlaubt zusätzlich auch die Möglichkeit der (lokalen) Defektoskopie, etwa einer Edelstahloberfläche in kritischen Schweißnahtbereichen.
Dabei ist zu beachten, dass der elektrochemische Polierabtrag im Gegensatz zum mechanischen Polierabtrag exakt definiert werden kann und v. a. werkstofftechnisch vollkommen belastungsfrei erfolgt. Dies bedeutet, dass elektrochemisch polierte Oberflächen topographisch dicht, geschlossen und mit einem Minimum der wahren Oberfläche vorliegen, morphologisch absolut legierungsrein und kristallin sind und betreffend Energieniveau (Oberflächenspannung und Ladungszustand) dem spezifischen ungestörten Legierungsniveau entsprechen.
Abb. E 9: Darstellung eines 2D-Rauheitsschriebes zur Ermittlung des Ra- / Rz-Wertes einer Oberfläche. (Quelle: G. Henkel)
Beim elektrochemischen Polieren, etwa von austenitischen Edelstahllegierungen 1,4404, 1.4435, 1.4539 mit Elektrolyten auf der Basis von Schwefelsäure / Phosphorsäure, können kalkulierbare Schichtabträge vorgenommen werden, die durch folgende Parameter definiert sind:
-
Stromdichte Ispez (anodische Stromdichte),
-
Zeit t,
-
Elektrolytqualität (Dichte, Metallgehalt),
-
Elektrolyttemperatur etc.
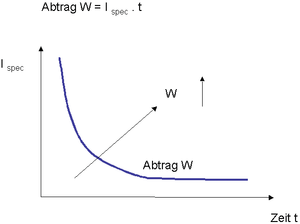
Bei Konstanthaltung aller übrigen Verfahrensparameter und Variation von Ispez und t ergibt sich folgender Zusammenhang für den elektrochemischen Abtrag W: W = Ispez x t.
Diese hyperbolische Funktion gibt an, dass höhere Stromdichten bei gleichem Abtragsziel W eine entsprechend kürzere Polierzeit erlauben. In der Praxis ist der zulässige Stromdichtebereich für technisch einwandfreie Elektropolierergebnisse für jede Paarung Werkstoff / Elektrolyt physikalisch begrenzt (Beispiel: mind. 8 A/dm2 bis max. 20 A/dm2) und kann durch entsprechende Stromdichtepotenzialmessungen (Stromdichtepotenzialkurve / Aktivbereich) bestimmt werden (Plateaubildung im U / I-Diagramm). Prozessanwendungen außerhalb des zulässigen Stromdichtebereichs sind sinnvollerweise zu vermeiden, da die Polierergebnisse technisch nicht brauchbar sind:
Abb. E 10: Formale Darstellung des Elektropolierabtrages W in Abhängigkeit von der Stromdichte und der Expositionszeit. (Quelle: G. Henkel)
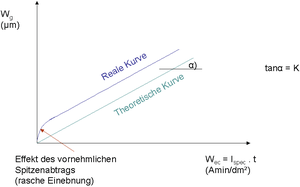
Abb. E 11: Schematische Darstellung des geometrischen Oberflächenabtrags zum elektrischen Ladungsausgleich samt elektrochemischem Äquivalent als Geradensteigung. (Quelle: G. Henkel)
Eine zu kleine Stromdichte führt zu anodischem Beizen (Elektrochemisches Beizen), durch eine zu hohe Stromdichte erfolgt eine unkontrollierte transpassive Metallauflösung („Verbrennen”).
Der elektrochemische Abtrag der Oberfläche erfolgt nicht nur an den Rauheitsspitzen der Oberfläche, sondern auch im Talbereich der Oberflächenrauheit. Allerdings ist der Abtrag an den exponierten Spitzen merklich stärker (Feldlinienkonzentration des elektrischen Feldes zwischen Anode und Kathode), sodass mit dem Polierfortschritt (Abtrag) bei richtiger Prozessführung automatisch eine signifikante (mikro-) topographische Einebnung erfolgt.
Technisch von Bedeutung ist die Ermittlung des Zusammenhangs zwischen elektrochemischem Abtrag (Ladungsaustausch) und geometrischem Abtrag (Wanddickenschwächung). Dieser Zusammenhang führt zum sogenannten elektrochemischen Äquivalent:
-
elektrochemischer Abtrag als elektrischer Ladungsaustausch Wec = Ispez x t (A min/dm2),
-
geometrischer Abtrag Wg (in µm) = K x Wec (A min/dm2).
Der funktionale Verlauf zwischen dem geometrisch messbaren Abtrag in µm und dem elektrischen Ladungsaustausch in A min/dm2 ist grundsätzlich linear mit einer Geradensteigung von tanα = K. Der Proportionalitätsfaktor K entspricht dem elektrochemischen Äquivalent als spezifischem Zusammenhang zwischen elektrochemischem und geometrischem Abtrag für eine spezielle Paarung Werkstoff / Elektrolyttyp.
Im Anfahrbereich zeigt die reale Kurve in Abb. E 11 meist eine progressive Wanddickenabnahme (in Abhängigkeit von der Ausgangsrauheit Ra [Roughness Average] der Oberfläche), zumal die topographische Einebnung durch anfangs vornehmlichen Spitzenabtrag einen erhöhten Wanddickenabtrag simuliert. Dieser Effekt nimmt rasch ab und die reale Kurve wird linearisiert.
Für die Ermittlung von K als Proportionalitätsfaktor zwischen geometrischem Abtrag Wg in µm und dafür notwendigem Ladungsaustausch Wec in A min/dm2 ergibt sich aus dem Zusammenhang Wec = Ispez x t:
Wg = K x Wec = K x Ispez x t
bzw. K = Wg / (Ispez x t).
Die Dimension von K ist
Für die Paarung 1.4435 oder 1.4404 zu Elektrolyt HE 111 (H2SO4 + H3PO4, γ = 1,72 kg/l bei 20 °C) ergibt sich z. B.:
K = 0,0725 µm x dm2/A min.
Unter den elektrochemischen Abtragsbedingungen 20 A/dm2 = Ispez als anodische Stromdichte und t = 15 min Expositionszeit z. B. ergibt sich der tatsächliche geometrische Abtrag Wg als
Wg = K x Wec = K x Ispez x t
Wg = 21,75 µm
Dieses Ergebnis kann durch Wanddickenmessung etwa mittels eines Mikrometers verifiziert werden.
© 2013 – ECV – Lexikon der Pharmatechnologie