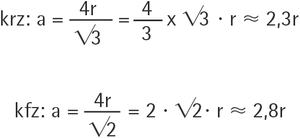Auch: Kristallit.
Dreidimensionales, periodisches Ordnungs- oder Aufbausystem von Stoffen, ausgehend von Atomen, Ionen oder Molekülen als kleinsten Einheiten. Kristalle werden von unterschiedlichsten Substanzen wie Salzen, Mineralien, Metallen und Legierungen, aber auch Proteinen und teilkristallinen Polymeren gebildet.
Bei Metallen und Metalllegierungen im Festzustand erfolgt die Kristallbildung ausgehend vom Metallatom als kleinster Einheit über das geordnete Einheitskristall (kubisch-flächenzentriert, kubisch-raumzentriert) zum Korn und letztlich zum Werkstoff als Kontinuum.
Als (Einheits-)Kristall bezeichnet man den geordneten Festkörper, dessen durch Gitterenergie zusammengehaltene Bausteine (Atome, Ionen, Moleküle) sich zu einem dreidimensionalen Kristallgitter angeordnet haben, wodurch eine Einteilung in Kristallsysteme, Kristallklassen und Raumgruppen erfolgen kann. Kristalle sind selten Idealkristalle, da Ordnungs- oder Gitterfehler meist zu entsprechenden Abweichungen von der idealen Ordnung führen.
Als Gitterenergie wird der Energiebetrag bezeichnet, der frei wird, wenn sich die in der Schmelze noch frei beweglichen Atome / Moleküle zum kristallinen Ordnungssystem zusammenlagern bzw. der aufgewendet werden muss, um die kristalline Ordnung (z. B. beim Schmelzen) wieder aufzuheben (z. B. Schmelzwärme in kJ / kg eines Stoffes). Die Schmelzwärme ist eine spezifische Stoffkonstante.
Das Kristallgitter ist die systematische Anordnung von als punktförmig aufgefassten Atomen, Ionen oder Molekülen in einem Kristall. Nach Art der chemischen Bindung zwischen den Atomen / Ionen / Molekülen erfolgt die Unterscheidung in Ionengitter, Atom- oder Valenzgitter, Molekülgitter und Metallgitter.
Das Metallgitter ist das Kristallgitter, nach dem sich Metallatome bzw. Metallionen anordnen.
Als Kristallsystem bezeichnet man die Einteilung der Kristalle nach Symmetrieoperationen an den Symmetrieelementen und den Winkeln und Abmessungen der Achsen wie z. B. kubisch, hexagonal, tetragonal etc.
Bei kubischen Systemen unterscheidet man kubisch raumzentrierte und kubisch flächenzentrierte.
Als Gitterfehler bezeichnet man Unregelmäßigkeiten im gleichförmigen systematischen Aufbau eines Gitters.
Metalle und im Besonderen austenitische Edelstahllegierungen sind dadurch gekennzeichnet, dass die Atome bzw. die positiven Metallionen im Metallgitter durch eine Wolke freier Elektronen (Elektronengas) zusammengehalten werden, was festkörperphysikalisch als Metallbindung (im Gegensatz zur hetero- und homöopolaren Valenzbindung) bezeichnet wird. Während etwa bei homöopolaren Kristallen (z. B. Zucker) gerichtete Bindungskräfte vorliegen und diese die Struktur bestimmen, zeigen im Gegensatz dazu Metallkristalle praktisch richtungsunabhängige Anziehungskräfte. Exakt damit sind die chemisch-physikalischen Voraussetzungen für die Bildung dichtester Kugelpackungen gegeben. Dies erklärt speziell auch für Edelstahllegierungen die dicht gepackten kfz bzw. krz Kugelstrukturen. Aus diesen regelmäßigen Strukturgebilden des Gitteraufbaus lassen sich kennzeichnende Koordinationszahlen(= Zahl der nächsten Nachbarn = Dichtheitsaussage) ermitteln, wobei Gitterfehler hierbei noch nicht berücksichtigt sind: Koordinationszahl für kfz: 12, Koordinationszahl für krz: 8. Daraus lassen sich für die beiden kubischen Gittertypen auch die Würfelkantenlängen a des kfz / krz Metallgitters (= Gitterparameter) ermitteln, wobei r dem mittleren Atomradius der Legierungselemente entspricht.
(Siehe auch Abb. K 19 unter Kubisch-flächenzentriert.)
Bei r = 1,26 Å (über Cr, Ni, Mo und Fe gemittelt) ergibt sich für kfz: a = 3,5 Å = 0,35 nm und krz: a = 2,9 Å = 0,29 nm. Auf Basis dieser Abschätzung der Würfelgröße mit den o. g. Koordinationszahlen bzw. der Atomanzahl pro Kristall (kfz = 14 Atome bzw. 4 Atome bei Mehrfachnutzung durch die benachbarten Kristalle und krz = 9 Atome bzw. 2 Atome bei Mehrfachnutzung durch die benachbarten Kristalle) lassen sich Überlegungen über die Kompaktheit der Packung anstellen, die auch für die Dichte, die Festigkeit, die Wärmeleitzahl, die elektrische Leitfähigkeit, die Wärmeausdehnung, die Wärmekapazität, das chemischen Beizen, die Passivierung, das elektrochemische Polieren und vor allem für die Passivschichtbildung (Passivschicht) und -struktur von fundamentaler Bedeutung sind.
© 2013 – ECV – Lexikon der Pharmatechnologie