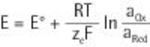Die Nernstsche Gleichung (benannt nach dem deutschen Physiker und Chemiker Walther Nernst, 1864–1941) drückt die Konzentrationsabhängigkeit des Elektrodenpotenzials eines Redox-Paares (Ox + ze– → Red) aus:
mit E = Elektrodenpotenzial, E° = Standardelektrodenpotenzial, R = universelle oder molare Gaskonstante (8,31447 J mol–1 K–1 = 8,31447 C V mol–1 K–1), T = absolute Temperatur, ze = Anzahl der übertragenen Elektronen (Äquivalentzahl), F = Faraday-Konstante (96.485,34 C mol–1 = 96.485,34 J V–1 mol–1, a = Aktivität des betreffenden Redox-Partners.
© 2013 – ECV – Lexikon der Pharmatechnologie