Beschreibt die elektrische Ladungsverteilung in Molekülen bzw. Molekülsegmenten mit typischen polarisierenden Atom- oder Hauptvalenzbindungen (Chemische Bindungen) bzw. Ionenbindungen.
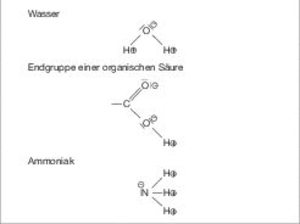
Eine polare Atom- oder Hauptvalenzbindung stellt einen Übergang dar zwischen der reinen (apolaren) Atombindung und der typischen polaren Ionenbindung (Salzbindung). Je mehr sich die Bindungspartner in ihrer Elektronegativität unterscheiden, um so polarer und auch stabiler ist die Bindung (Abb. P 5).
Polare Gruppen (Moleküle oder Molekülsegmente) verhalten sich meist hydrophil bzw. lipophob.
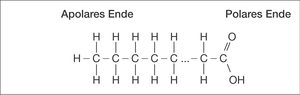
Fallweise zeigen größere Molekülgebilde auch an einem Ende polares und am anderen Ende apolares Verhalten (Abb. P 6).
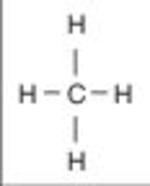
Durch Symmetrie heben sich Polaritäten gelegentlich nach außen auf (Abb. P 7).
Abb. P 5: Beispiele für stark polare Bindungsverhältnisse mit typischem Dipolcharakter (Dipol): ⊖ = negative Ladungskonzentration, ⊕ = positive Ladungskonzentration. (Quelle: G. Henkel)
Abb. P 6: Makromolekül mit apolarem und polarem Ende. (Quelle: G. Henkel)
Abb. P 7: Methan als Beispiel für das Aufheben von Polaritäten aufgrund von Symmetrie. (Quelle: G. Henkel)
© 2013 – ECV – Lexikon der Pharmatechnologie