Bei der Entwicklung neuer Wirkstoffe (API) ist die präklinische Prüfung ein fester Bestandteil der Pharmaforschung. Die im Tiermodell erhobenen Daten bilden die Grundlage für spätere Studien. Daher sind bei der Planung entsprechender Forschungsanlagen die regulatorischen Anforderungen hinsichtlich Tierhaltung und Tierschutz, aber auch insbesondere der Laborplanung und -organisation zu beachten.
Für den Anwendungsfall der präklinischen Prüfung haben innerhalb der Forschungsanlagen die Umgebungsbedingungen Temperatur und Luftfeuchtigkeit einen direkten Einfluss auf die Tierhaltung. Weitere Parameter sind mikrobiologische Kontamination und das Vorhandensein von Schweb- und Fremdstoffen, die auch direkte Auswirkungen auf das Personal und die Umgebung haben können. Die Räumlichkeiten (Böden, Wände, Decken, Equipment) müssen für die beabsichtigten Zwecke geeignet sein und so ausgestaltet werden, dass das Risiko von Fehlern auf das minimale Maß eingeschränkt wird. Zusätzlich spielen Aspekte der Biosafety und der Biosecurity eine entscheidende Rolle bei der Auslegung der gesamten Forschungsumgebung. Neben den genannten Gesichtspunkten ist aber auch die Kostenseite, vor allem für den laufenden Betrieb der Forschungsanlagen, nicht zu vernachlässigen. Ein hoher Grad an Automatisierung in Verbindung mit der Nutzung neuer Technologien z. B. für die Tierhaltung (Tracking, Käfigtransport) bildet eine der Grundlagen für einen kostenoptimierten laufenden Betrieb.
Planungsschwerpunkt Raumdesign
Die Trennung des Raumdesigns in saubere und kontaminierte Zonen bildet eine der essenziellen Planungsgrundlagen, um eine Kreuzkontamination im laufenden Betrieb auszuschließen. Beispielhaft ist in den Abbildungen ein optimaler Personal- sowie Tier- und Materialfluss unter Berücksichtigung dieser Vorgabe dargestellt. Um die in den Biosafety-Laboren geforderten Reinheitsbedingungen zu gewährleisten, werden unter anderem spezielle Arbeitskleidung, Arbeitsmittel und Werkzeuge sowie Spezialtechnik eingesetzt. Der Zugang zu den Laboren findet in der Regel über eine Folge verschiedener Bereiche mit steigender Sicherheitsklasse statt. Die verschiedenen Bereiche sind durch Schleusen (jeweils für Material und Personal) getrennt. Innerhalb der Schleusen muss die Schutzkleidung der Mitarbeiter den jeweiligen Anforderungen der nächsthöheren Sicherheitsklasse angepasst werden. Um zu vermeiden, dass eine Kontamination von innen nach außen erfolgt, wird mit einem Druckstufenkonzept gearbeitet. Hierbei nimmt die negative Druckdifferenz mit steigender Sicherheitsklasse zu. Bereits während der Planung der Biosafety-Labore werden die speziellen Anforderungen der Sicherheitsklassen berücksichtigt.
Ausführung der Böden
Für die Einhaltung der Hygienevorgaben in Biosafety-Laboren werden hohe Anforderungen an die Ausführung der Räumlichkeiten gestellt. Unter anderem für Bodenbeläge werden neben geringer Partikelemission (z. B. durch Abrieb), minimaler Aufladungsneigung auch bestmögliche Reinigungs-, Desinfektions- und Dekontaminationseigenschaften gefordert. Auch zukünftige Verkehrslasten müssen berücksichtigt werden sowie gegebenenfalls die nötige Rutschhemmung (auch im feuchten Zustand).
Ebenso müssen für die Ausführung der Böden, Wände und Decken Stoßstellen und Fugen auf ein Minimum reduziert werden. Zur Vermeidung von Kanten, in denen Schmutzablagerungen (Partikel) auftreten können, werden Rundungen in Form von Hohlkehlen ausgebildet. Für die bestmögliche, gründliche Reinigung werden glatte, durchgängige und damit leicht zu reinigende Oberflächen eingesetzt. Die eingesetzten Materialien müssen abriebfest und resistent gegenüber Desinfektions- und Reinigungsmitteln sein und dürfen keinen Nährboden für Keime bilden. Projektbezogen sind z. B. auch Vorgaben zu Leitfähigkeit und antistatische Eigenschaften der eingesetzten Materialien einzuhalten.
Planungsleistungen überprüft
PlantIng bearbeitet gemeinsam mit dem Kooperationspartner im Bereich Qualifizierung, der Pitzek GMP Consulting, Projekte im Umfeld der oben beschriebenen Forschungsanlagen. Eines dieser Projekte umfasst die Überprüfung und Kommentierung von Planungsleistungen für den Neubau eines internationalen Biotechnologiezentrums. Das Zentrum umfasst ca. 100 Einzellabore sowie fünf Großraumlabore der Biosicherheitsstufe 2. Hinzu kommen fünf Laborsuiten der Sicherheitsstufe 3, an die besondere Ansprüche hinsichtlich der Behandlung der Abluft gestellt werden, da die Verbreitung von Mikroorganismen über Aerosole ausgeschlossen werden muss. Eine besondere Herausforderung stellt die Prüfung und Kommentierung der Planung des Tierhauses innerhalb der Forschungsanlage dar, in dem neben Nagern auch nicht humane Primaten (z. B. Rhesusaffen) gehalten werden sollen und in dem ebenfalls Labore der Sicherheitsstufe 3 (Animal Biosafety Level 3, ABSL-3) vorgesehen sind. Die Konzeptionierung der Räume und Schleusen hierfür hat unter Berücksichtigung der erforderlichen Druckzonen sowie der Festlegung von Personen-, Tier- und Materialflüssen zu erfolgen.
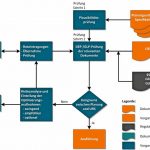
Ungewöhnlicher Prüfungszeitpunkt
Im Rahmen der Projektbearbeitung wurden von Kundenseite erstellte Zeichnungen und Spezifikationen geprüft und kommentiert. Die Größe des Projekts spiegelt sich im Umfang der zu prüfenden Dokumente wider. Es waren 790 Zeichnungen aus den Gewerken Bau, Architektur, Mechanik und Elektrik und 130 Spezifikationen für die Beschaffenheit und die Ausführung von Räumen und Equipment zu prüfen. Die Besonderheit im Rahmen dieser Prüfung stellte der späte Zeitpunkt im Projektablauf dar. Findet normalerweise eine fundierte Qualifizierungsplanung und -überwachung von Beginn der Planungsphase bis über den gesamten Projektablauf statt, so wurde hier die Prüfung zur Einhaltung der Spezifikationen erst zu einem Zeitpunkt beauftragt, an dem bereits bauliche Maßnahmen eingeleitet waren. Dies erschwerte die Aufgabenstellung erheblich im Hinblick auf die planerischen Möglichkeiten und die Optimierungsmaßnahmen zur Spezifikationseinhaltung.
Die Überprüfung und Kommentierung erfolgte auf Basis eines im Vorfeld definierten Prozessablaufs. Im ersten Schritt wird eine Plausibilitätsprüfung durchgeführt, in der vor allem formale Aspekte zur Prüfung herangezogen werden. Im zweiten Prüfschritt erfolgt eine Prüfung unter Good-Engineering-Practice- und Good-Laboratory-Practice- (GEP-/GLP-)Gesichtspunkten. Basis hierfür bilden die Planungsunterlagen (Zeichnungen und Spezifikationen) und die User Requirement Specification (URS) des Kunden sowie die relevanten regulatorischen Anforderungen. Bei der Feststellung von Abweichungen (fehlende Kongruenz) werden Maßnahmen ermittelt und mithilfe einer Risikoanalyse in die Kategorien „Zwingend“, „Empfohlen“ und „Optional“ eingeteilt. Die anschließende Kommentierung erfolgt in Form eines Prüfberichts.
Ergänzend zu den Roteintragungen in den Planungsdokumenten werden Konzepte für Optimierungsmaßnahmen erstellt. Die Übernahme der Roteintragungen auf den Zeichnungen und den Spezifikationen wird anschließend erneut geprüft. Erst bei vorliegender Kongruenz zwischen Planung und URS werden die Planungsdokumente zur Ausführung freigegeben.
Aufgabe gelöst
PlantIng sah sich im vorliegenden Projekt zweifelsohne mit einer ungewöhnlichen Aufgabenstellung konfrontiert: Zum einen ist eine semi-retrospektive Planungsprüfung nach GEP- und GLP-Gesichtspunkten nicht alltäglich, da es nicht dem klassischen Planungsablauf entspricht. Zum anderen war bei der Festlegung der Optimierungsmaßnahmen stets der aktuelle Baufortschritt im Auge zu behalten, um eine realistische Implementierbarkeit der Maßnahmen auch in diesem fortgeschrittenen Stadium zu gewährleisten. Trotz dieser ungewöhnlichen Umstände konnten alle Planungsinkonsistenzen zuverlässig aufgezeigt und entsprechende realitätsbezogene Optimierungsmaßnahmen vorgestellt werden.
www.prozesstechnik-online.deSuchwort: php0415planting
Oliver Franke
Standortleiter, PlantIng
Thomas Pitzek
Inhaber, Pitzek GMP Consulting
Unsere Whitepaper-Empfehlung
Absicherung der IT-Infrastruktur bei der Lebensmittelindustrie und im Lebensmittelhandel unter KRITIS-Vorgaben: Fakten und Lösungen
Teilen: