Seit etlichen Jahren spielt die Validierung computergestützter Systeme in der Pharmaindustrie eine wichtige Rolle. Aber auch für Lebensmittelhersteller ist dieses Thema von großer Bedeutung. Die Computer-Validierung ist der dokumentierte Nachweis der korrekten Funktionsweise von computergestützten Arbeitsabläufen in der Produktion. Sie ist ein wesentliches Hilfsmittel bei der wirtschaftlichen und langfristigen Qualitätssicherung.
Was heißt Computer-Validierung. Validierung meint in diesem Zusammenhang den dokumentierten Nachweis der korrekten Funktionsweise bei computergestützten Arbeitsabläufen in der Produktion. Die Einhaltung gesetzlicher Auflagen bei der Validierung von computergestützten Systemen ist essentiell für deren industriellen Einsatz. Die gesetzten Standards nicht zu erfüllen, birgt bei Inspektionen durch Aufsichtsorgane und Kontrollbehörden große Gefahren. Eine zeitweilig angeordnete Produktionsunterbrechung führt beispielsweise zu erheblichen finanziellen Verlusten. Die Validierung eines Systems ist somit aus rechtlichen und betriebswirtschaftlichen Gründen unerlässlich.
Die Anforderungen und Richtlinien von GMP und FDA sind jedoch oft zu allgemein und wenig konkret formuliert, so dass Projektverantwortliche Schwierigkeiten mit dem Thema „Validierung“ haben. Mit dem fehlenden Know-how ist häufig auch ein hoher Aufwand an Kosten und Zeit verbunden, der als Hemmschuh in der Projektumsetzung betrachtet wird. Denn die Validierung stellt die Unternehmen vor Probleme: Die Umsetzung der Validierungsanforderungen, ein enggefasster Zeitrahmen und die Verfügbarkeit der erforderlichen Ressourcen.
Fester und äußerst wichtiger Bestandteil der Validierungsprozedur ist beispielsweise die saubere und genaue Spezifikation des Las-tenhefts im Vorfeld einer Projektrealisierung. In dieser Projektphase muss geklärt werden, welche Aufgaben und Funktionalitäten die einzusetzende Software haben soll. Dieser Phase wird oft zu wenig Bedeutung beigemessen. Die Unternehmen gehen pragmatisch vor, beschreiten den Weg der kleinen Schritte und bedenken die Ganzheitlichkeit des Systems nicht. Die Vorteile, die sich durch validierte Computersysteme ergeben, treten in den Hintergrund. Die Chance, die Prozess- und Systemqualität zu optimieren, wird häufig noch nicht erkannt. In diesen Zusammenhang gehört beispielsweise, dass eine gute Systemdokumentation die spätere Wartung des Systems erheblich erleichtert.
Mit der Jahrtausendwende zeichnet sich jedoch der Trend ab, die Validierung nicht nur als notwendiges Übel, sondern als Gewinn zu betrachten. Die Validierung und Qualifizierung von Informationstechnologie prägt sich im Qualitätsbewusstsein von Unternehmen immer mehr ein. Wie sehen nun die Entwicklungen in der Computer-Validierung selbst aus?
Entwicklungstrends in der Computer-Validierung
Generell gelten für ein zu validierendes Computersystem folgende Einflussfaktoren:
• GxP-gerechte Funktionalität,
• GxP-gerechte Entwicklung,
• GxP-gerechte Projektierung.
Die GxP-gerechte Funktionalität eines Computersystems wird durch konsequente Umsetzung der regulatorischen Richtlinien in User-Requirements des Systems sichergestellt. Moderne branchenspezifische Lösungen tragen dem bereits weitgehend Rechnung, wobei allerdings die Weiterent- wicklung gemäß der kontinuierlich angepassten Richtlinien der cGxP sichergestellt sein muss. Wichtig hierbei ist, dass das System nicht nur die Einhaltung der GxP-Anforderungen erlauben, sondern diese aktiv unterstützen bzw. – wo sinnvoll – erzwingen sollte. Bei der erfolgreichen Umsetzung dieser Konzepte spielt die Branchenerfahrung des Softwareherstellers eine entscheidende Rolle.
Die GxP-gerechte Entwicklung eines Computersystems setzt die Implementierung eines konsequent umgesetzten und effektiven Qualitätsmanagement-Systems, beispielsweise nach DIN EN ISO 9001, voraus. Allerdings gehen die Anforderungen der GxP noch weiter, zum Beispiel, was Testmethoden, Testtiefe und vor allem System- und Testdokumentation anbelangt. Der Audit-Trail, also die Nachvollziehbarkeit sämtlicher Spezifikations-, Design- und Qualifizierungsschritte, muss in der gesamten Entwicklungsdokumentation gewährleistet sein. Beim Einsatz von Individualsoftware, d. h. bei einer für eine spezifische Anwendung entwickelten Software, kann die GxP-Konformität der Software projektspezifisch sichergestellt werden.
Konfigurierbare Standard-Softwaresysteme
Anders sieht dies bei den heute und besonders in Zukunft immer stärker eingesetzten „konfigurierbaren Standard-Softwaresystemen“ (ERP-Systeme, wie SAP R/3 oder MES-Lösungen wie PMX) aus. Die Anbieter entsprechen den Erfordernissen dahingehend, dass immer häufiger eine Validierungsdokumentation in Form von sogenannten „Validierungspaketen“ angeboten wird. Diese Dokumentation kann man unverändert übernehmen oder falls erforderlich an das jeweilige Customizing anpassen. Ferner kann sie für die stets notwendigen Onsite-Validierungstests herangezogen werden. Abgerundet werden diese Pakete durch den auf das System abgestimmten Validierungsservice des Herstellers, um eine effiziente Durchführung der Validierung zu erzielen.
Gerade in Verbindung mit Standardsystemen wäre eine GxP-Zertifizierung der Produkte durch unabhängige Zertifizierungsstellen nach international gültigen Richtlinien wünschenswert. Aufgrund der leichten Anpassbarkeit, Änderbarkeit und somit Schnelllebigkeit der Software, ist dies in vielen Fällen jedoch nur schwer umzusetzen.
Zertifizierung des Softwareent-wicklungsprozesses
Erfolgversprechender scheint hier eine Zertifizierung des Softwareentwicklungsprozesses analog zu DIN EN ISO 900A hinsichtlich der Einhaltung der erwähnten GxP-Anforderungen zu sein. Vorteil hierbei ist eine einheitliche Vorgehensweise und Beurteilungsbasis. Das Zertifikat gibt zuverlässig Auskunft über die Einhaltung der GxP-Anforderungen beim Lieferanten. Somit sind auch die für beide Seiten zeitraubenden Audits im Zuge der Lieferantenauswahl hinfällig. Voraussetzung hierfür ist eine verbindliche und hinreichend konkrete Formulierung der Anforderungen an ein GxP-gerechtes QM-System für die Softwareentwicklung und -projektierung.
Die internationale Harmonisierung der Anforderungen muss hierfür noch weiter vorangetrieben werden. Erfolgversprechende Ansätze, zumindest im Bereich der Validierungsleitlinien, existieren bereits, beispielsweise der weithin bekannte GAMP-Leitfaden (Version 3.0) oder die Ergebnisse des GMA-Namur-Arbeitskreises 5.8 „Leittechnikvalidierung nach GMP“. Letztere sind auch als VDI/VDE-Richtlinie 3517 erschienen.
Als Vorbild für die Definition der Anforderungen an ein GxP-gerechtes QM-System für die Softwareentwicklung könnte auch die FDA-Richtlinie 21CFR Parts 802, 812, 826 Medical Devices, Current Good Manufacturing Practice (CGMP) für Medizinprodukte dienen.
Realisierungs- und Integrations-strategien des Computersystems
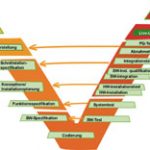
Die GxP-gerechte Projektierung muss unabhängig vom Typ der eingesetzten Software stets individuell sichergestellt werden, wobei der hier entstehende Aufwand unabhängig von Vorleistung des Lieferanten ist. Essentiell ist die Anwendung eines geeigneten Software-Life-Cycle-Modells wie des V-Modells, das alle Phasen von der Erfassung der Benutzeranforderungen bis hin zur Performance Qualification abdeckt. Bietet der Lieferant des Computersystems im Rahmen seines Validierungsservices eine abgestimmte Realisierungs- und Integrationsstrategie an, so erhöht dies die Effizienz und den Erfolg des Projekts wesentlich. Idealerweise liefert er mit seinem Validierungspaket bereits Templates für systemspezifische SOPs, die – angepasst an die Organisation des Anwendungsbereichs – den GxP-gerechten Betrieb des Systems zu gewährleisten.
Weitere Informationen dei 249
Unsere Whitepaper-Empfehlung
Wasserstoff gilt als Schlüssel für die Dekarbonisierung der Chemieindustrie. Doch die Nutzung des vermeintlichen Hoffnungsträgers Hydrogen birgt auch Gefahren und stellt die Branche vor neue Herausforderungen, die das gratis Whitepaper „H2 wie Hoffnungsträger?“ näher für Sie…
Teilen: